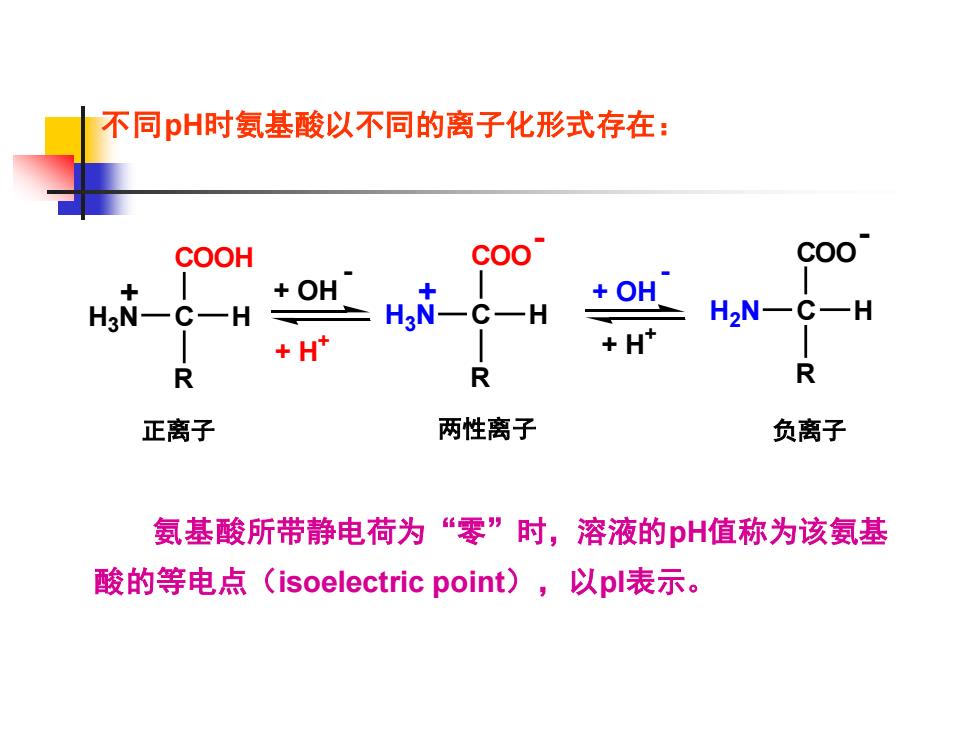
不同pH时氨基酸以不同的离子化形式存在: H3 N C H COOH R H3 N C H COO R - + + + H + + OH - + H + + OH - H2 N C H COO R - 正离子 两性离子 负离子 氨基酸所带静电荷为“零”时,溶液的pH值称为该氨基 酸的等电点(isoelectric point),以pI表示
不同pH时氨基酸以不同的离子化形式存在: H3 N C H COOH R H3 N C H COO R - + + + H + + OH - + H + + OH - H2 N C H COO R - 正离子 两性离子 负离子 氨基酸所带静电荷为“零”时,溶液的pH值称为该氨基 酸的等电点(isoelectric point),以pI表示
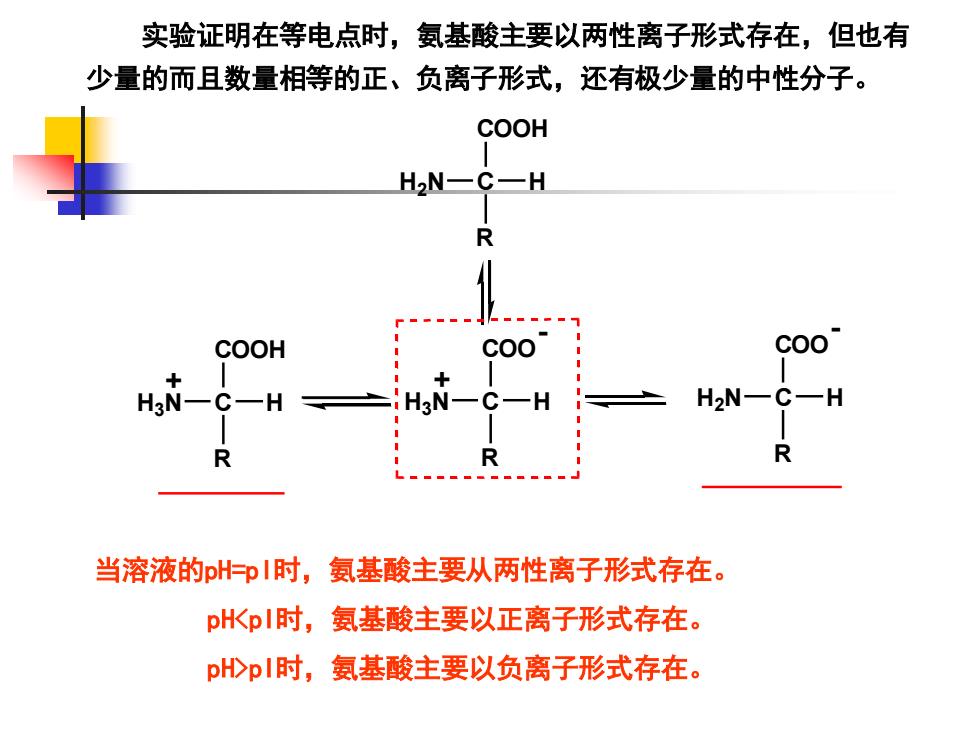
实验证明在等电点时,氨基酸主要以两性离子形式存在,但也有 少量的而且数量相等的正、负离子形式,还有极少量的中性分子。 当溶液的pH=pI时,氨基酸主要从两性离子形式存在。 pH<pI时,氨基酸主要以正离子形式存在。 pH>pI时,氨基酸主要以负离子形式存在。 H3 N C H COOH R H3 N C H COO R - + + H2 N C H COO R - H2 N C H COOH R
实验证明在等电点时,氨基酸主要以两性离子形式存在,但也有 少量的而且数量相等的正、负离子形式,还有极少量的中性分子。 当溶液的pH=pI时,氨基酸主要从两性离子形式存在。 pH<pI时,氨基酸主要以正离子形式存在。 pH>pI时,氨基酸主要以负离子形式存在。 H3 N C H COOH R H3 N C H COO R - + + H2 N C H COO R - H2 N C H COOH R
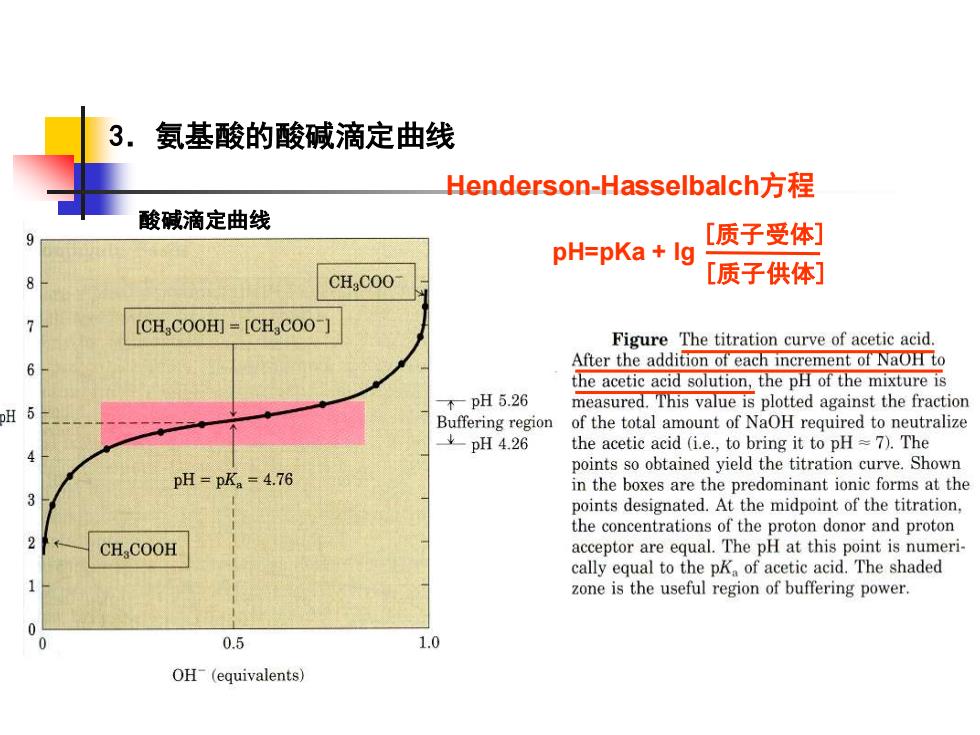
3.氨基酸的酸碱滴定曲线 Henderson-Hasselbalch方程 pH=pKa + lg [质子受体] [质子供体] 酸碱滴定曲线
3.氨基酸的酸碱滴定曲线 Henderson-Hasselbalch方程 pH=pKa + lg [质子受体] [质子供体] 酸碱滴定曲线
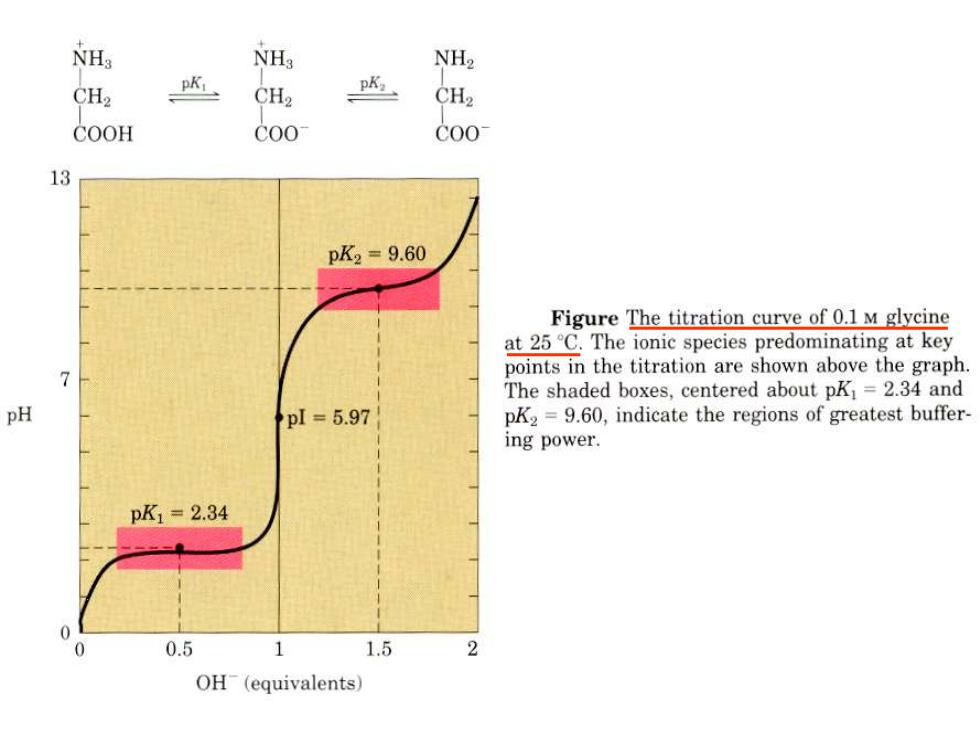
NHg NH3 NH2 CH2 CH2 CH2 COOH C00 C00 13 pK2=9.60 Figure The titration curve of 0.1 M glycine at 25C.The ionic species predominating at key points in the titration are shown above the graph. 7 The shaded boxes,centered about pKi=2.34 and pH pl=5.97 pK2=9.60,indicate the regions of greatest buffer- ing power. pK1=2.34 0 0 0.5 1 1.5 2 OH(equivalents)
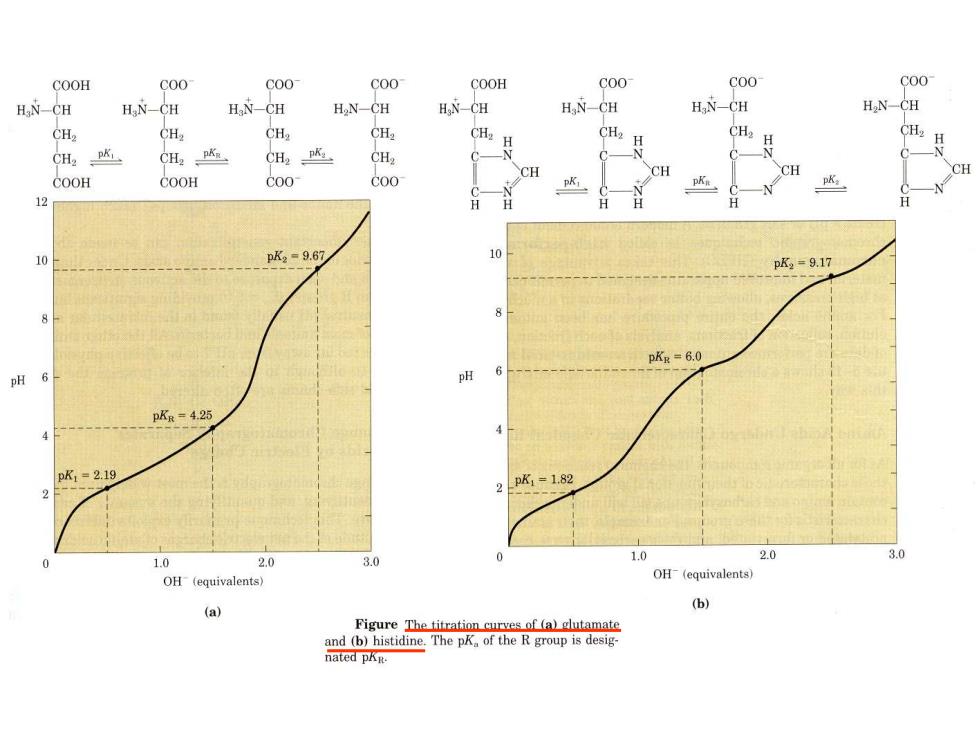
COOH C00 C00 C00 COOH C00 C00 C00 H.N-CH H N-CH HaN-CH H2N-CH HNC阻 HaN-CH HN-CH HN-CH CH2 CH CH2 CHa H CH2 CHapK CH2 PK CH2PK CH2 N CH CH CH COOH C00 C00 pK: pK: 10 pK2=9.67 pK2=9.17 pKR =6.0 pH 6 pH p5=4.25 4 pK1=2.19 2pk=1.82 1.0 2.0 3.0 1.0 2.0 3.0 OH (equivalents) OH (equivalents) (a) (b) Figure The titration curves of (a)glutamate and (b)histidine.The pK of the R group is desig- nated pAn