
饱和烃 由碳和氢两种元素组成的化合物叫做碳氢化合物,简称为烃。其他有机化合 物都可以看作是烃的衍生物,所以烃是有机化合物的母体 根据分子中碳骨架的不同,可将烃分为两大类:链烃(又称脂肪烃)和环烃。 根据碳原子间互相连接的化学键不同,可将链烃分为饱和烃链和不饱和链烃。饱 和链烃也称烷烃:不饱和链烃包括烯烃和炔烃:环烃可分为脂环烃和芳香烃。其 中,烷烃和环烷烃都是饱和烃。 「饱和链烃——烷烃 「链烃 烯烃 不饱和链烃 炔烃 「脂环烃 环烃 芳香烃 烷烃 一、烷烃的定义、通式和同系列 烷烃分子中的所有碳原子都以碳碳单键(C一C)相连,其余的价键都与氢原 子结合 在烷烃分子中,与碳原子结合的氢原子数目达到了最大值,故称饱和烃。碳 原子互相连接成“链状”的碳氢化合物称为链烃,也叫脂肪烃。烷烃是饱和链烃。 从上面几个烷烃的分子式可以看出,烷烃的分子组成可以用通式CH+2来 表示。从烷烃的结构式可以看出,它们的结构相似,相邻两个分子之间相差一 个CH,不相邻的两个分子之间相差两个或多个CH。像这种结构相似,组成 上相差一个或多个CH(称为系列差)的一系列化合物,称为同系列。同系列中各 化合物互称为同系物。同系物的结构相似,性质也相近。除了烷烃同系列之外, 还有其他同系列,因此,同系列是有机化学中的普遍现象
饱和烃 由碳和氢两种元素组成的化合物叫做碳氢化合物,简称为烃。其他有机化合 物都可以看作是烃的衍生物,所以烃是有机化合物的母体。 根据分子中碳骨架的不同,可将烃分为两大类:链烃(又称脂肪烃)和环烃。 根据碳原子间互相连接的化学键不同,可将链烃分为饱和烃链和不饱和链烃。饱 和链烃也称烷烃;不饱和链烃包括烯烃和炔烃;环烃可分为脂环烃和芳香烃。其 中,烷烃和环烷烃都是饱和烃。 烃 链烃 环烃 饱和链烃—— 不饱和链烃 烯烃 炔烃 烷烃 脂环烃 芳香烃 烷 烃 一、烷烃的定义、通式和同系列 烷烃分子中的所有碳原子都以碳碳单键(C-C)相连,其余的价键都与氢原 子结合。 在烷烃分子中,与碳原子结合的氢原子数目达到了最大值,故称饱和烃。碳 原子互相连接成“链状”的碳氢化合物称为链烃,也叫脂肪烃。烷烃是饱和链烃。 从上面几个烷烃的分子式可以看出,烷烃的分子组成可以用通式 CnH2n+2 来 表示 。从烷烃的结构式可以看出,它们的结构相似,相邻两个分子之间相差一 个 CH2,不相邻的两个分子之间相差两个或多个 CH2 。像这种结构相似,组成 上相差一个或多个 CH2(称为系列差)的一系列化合物,称为同系列。同系列中各 化合物互称为同系物。同系物的结构相似,性质也相近。除了烷烃同系列之外, 还有其他同系列,因此,同系列是有机化学中的普遍现象

二、烷烃的结构 (一)甲烷的立体构型 甲烷是最简单的烷烃,其分子式是CH4。实验证明,甲烷分子里的1个碳原 子和4个氢原子形成一个正四面体的立体结构。碳原子位于正四面体的中心,4 个氢原子位于正四面体的4个顶点上。碳原子的4个价键之间的键角彼此相等, 都是10928',4个碳氢键都相同,如下图所示。甲烷分子的正四面体构型可用 球棍模型或比例模型直观地表示,如图下所示。 图甲烷分子结构示意图 图甲烷分子棋型 (二)烷烃碳原子的sp3杂化 甲烷的立体结构用普通原子轨道重叠成键是不能解释的,为了解决这个问题 鲍林(Pauling)等人提出了杂化轨道理论。 杂化轨道理论认为,在形成烷烃时,碳原子的2s轨道中的1个电子跃迁到 2印轨道上去,跃迁时所需要的能量可以从成键时所产生的能量得到补偿。这样 碳原子就具有4个各占据1个轨道的未成对电子,因此表现为四价。为了使形成 的化学键更加牢固,更有利于体系能量的降低,4个单电子轨道(1个2s轨道、3 个2p轨道)进行杂化(混合),形成能量相等、形状相同的4个s即3杂化轨道。 L&,四2ap2 四n39 ①sp,1 2s sp'sp'sp'sp 每个sp杂化轨道含有1/4的s轨道成分和34的p轨道成分,4个sp杂化 轨道对称地指向正四面体的四个顶点,相互之间的夹角均为10928。如下图所 示
二、烷烃的结构 (一)甲烷的立体构型 甲烷是最简单的烷烃,其分子式是 CH4。实验证明,甲烷分子里的 1 个碳原 子和 4 个氢原子形成一个正四面体的立体结构。碳原子位于正四面体的中心,4 个氢原子位于正四面体的 4 个顶点上。碳原子的 4 个价键之间的键角彼此相等, 都是 109º28΄,4 个碳氢键都相同,如下图所示。甲烷分子的正四面体构型可用 球棍模型或比例模型直观地表示,如图下所示。 图 甲烷分子结构示意图 图 甲烷分子模型 (二)烷烃碳原子的 sp3杂化 甲烷的立体结构用普通原子轨道重叠成键是不能解释的,为了解决这个问题, 鲍林(Pauling)等人提出了杂化轨道理论。 杂化轨道理论认为,在形成烷烃时,碳原子的 2s 轨道中的 1 个电子跃迁到 2p 轨道上去,跃迁时所需要的能量可以从成键时所产生的能量得到补偿。这样 碳原子就具有 4 个各占据 1 个轨道的未成对电子,因此表现为四价。为了使形成 的化学键更加牢固,更有利于体系能量的降低,4 个单电子轨道(1 个 2s 轨道、3 个 2p 轨道)进行杂化(混合),形成能量相等、形状相同的 4 个 sp 3杂化轨道。 激发 2s 2px2py2pz 2px2py2pz 2s sp 3 sp 3 sp 3 sp 3 sp 杂化 3 每个 sp3 杂化轨道含有 1/4 的 s 轨道成分和 3/4 的 p 轨道成分,4 个 sp3杂化 轨道对称地指向正四面体的四个顶点,相互之间的夹角均为 109°28΄。如下图所 示
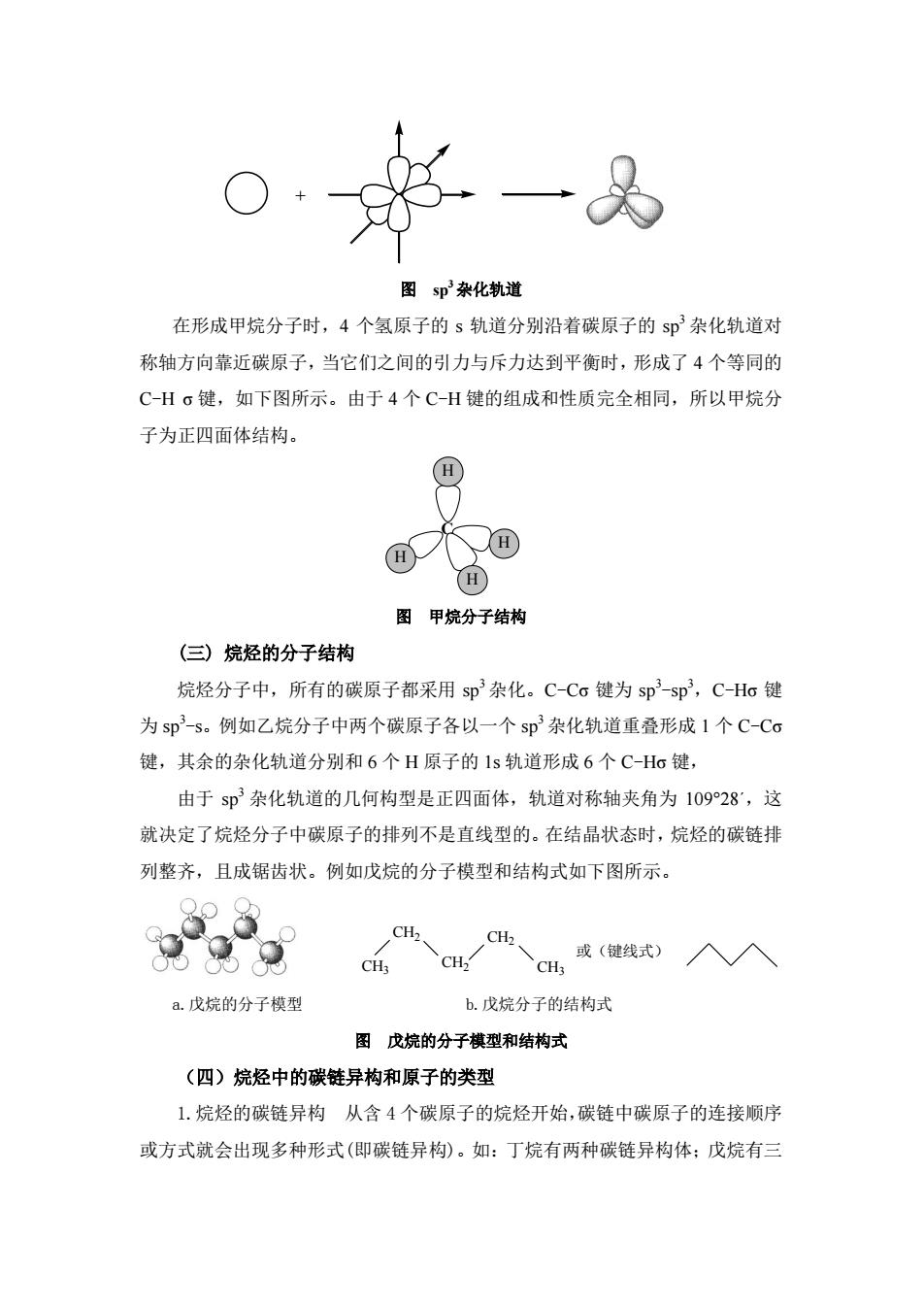
一 图邓杂化轨道 在形成甲烷分子时,4个氢原子的s轨道分别沿着碳原子的sp杂化轨道对 称轴方向靠近碳原子,当它们之间的引力与斥力达到平衡时,形成了4个等同的 C-H。键,如下图所示。由于4个C-H键的组成和性质完全相同,所以甲烷分 子为正四面体结构。 图甲烷分子结构 (三)烷烃的分子结构 烷烃分子中,所有的碳原子都采用sp杂化。C-Cc键为sp3-sp3,C-Ho键 为sp-s。例如乙烷分子中两个碳原子各以一个s即杂化轨道重叠形成1个C-Cσ 键,其余的杂化轨道分别和6个H原子的1s轨道形成6个C-Hσ键 由于sp杂化轨道的几何构型是正四面体,轨道对称轴夹角为10928,这 就决定了烷烃分子中碳原子的排列不是直线型的。在结晶状态时,烷烃的碳链排 列整齐,且成锯齿状。例如戊烷的分子模型和结构式如下图所示。 CH2 H或(键线式)入入 a.戊烷的分子模型 b.戊烷分子的结构式 图戊烷的分子棋型和结构式 (四)烷烃中的碳链异构和原子的类型 1.烷烃的碳链异构从含4个碳原子的烷烃开始,碳链中碳原子的连接顺序 或方式就会出现多种形式(即碳链异构)。如:丁烷有两种碳链异构体:戊烷有三
+ 图 sp 3杂化轨道 在形成甲烷分子时,4 个氢原子的 s 轨道分别沿着碳原子的 sp3 杂化轨道对 称轴方向靠近碳原子,当它们之间的引力与斥力达到平衡时,形成了 4 个等同的 C-H σ 键,如下图所示。由于 4 个 C-H 键的组成和性质完全相同,所以甲烷分 子为正四面体结构。 C H H H H 图 甲烷分子结构 (三) 烷烃的分子结构 烷烃分子中,所有的碳原子都采用 sp3 杂化。C-Cσ 键为 sp3 -sp3,C-Hσ 键 为 sp3 -s。例如乙烷分子中两个碳原子各以一个 sp3 杂化轨道重叠形成 1 个 C-Cσ 键,其余的杂化轨道分别和 6 个 H 原子的 1s 轨道形成 6 个 C-Hσ 键, 由于 sp3 杂化轨道的几何构型是正四面体,轨道对称轴夹角为 109°28΄,这 就决定了烷烃分子中碳原子的排列不是直线型的。在结晶状态时,烷烃的碳链排 列整齐,且成锯齿状。例如戊烷的分子模型和结构式如下图所示。 CH3 CH2 CH2 CH2 CH3 或(键线式) CH3 CH2 CH2 CH2 CH3 或(键线式) a.戊烷的分子模型 b.戊烷分子的结构式 图 戊烷的分子模型和结构式 (四)烷烃中的碳链异构和原子的类型 1.烷烃的碳链异构 从含 4 个碳原子的烷烃开始,碳链中碳原子的连接顺序 或方式就会出现多种形式(即碳链异构)。如:丁烷有两种碳链异构体;戊烷有三

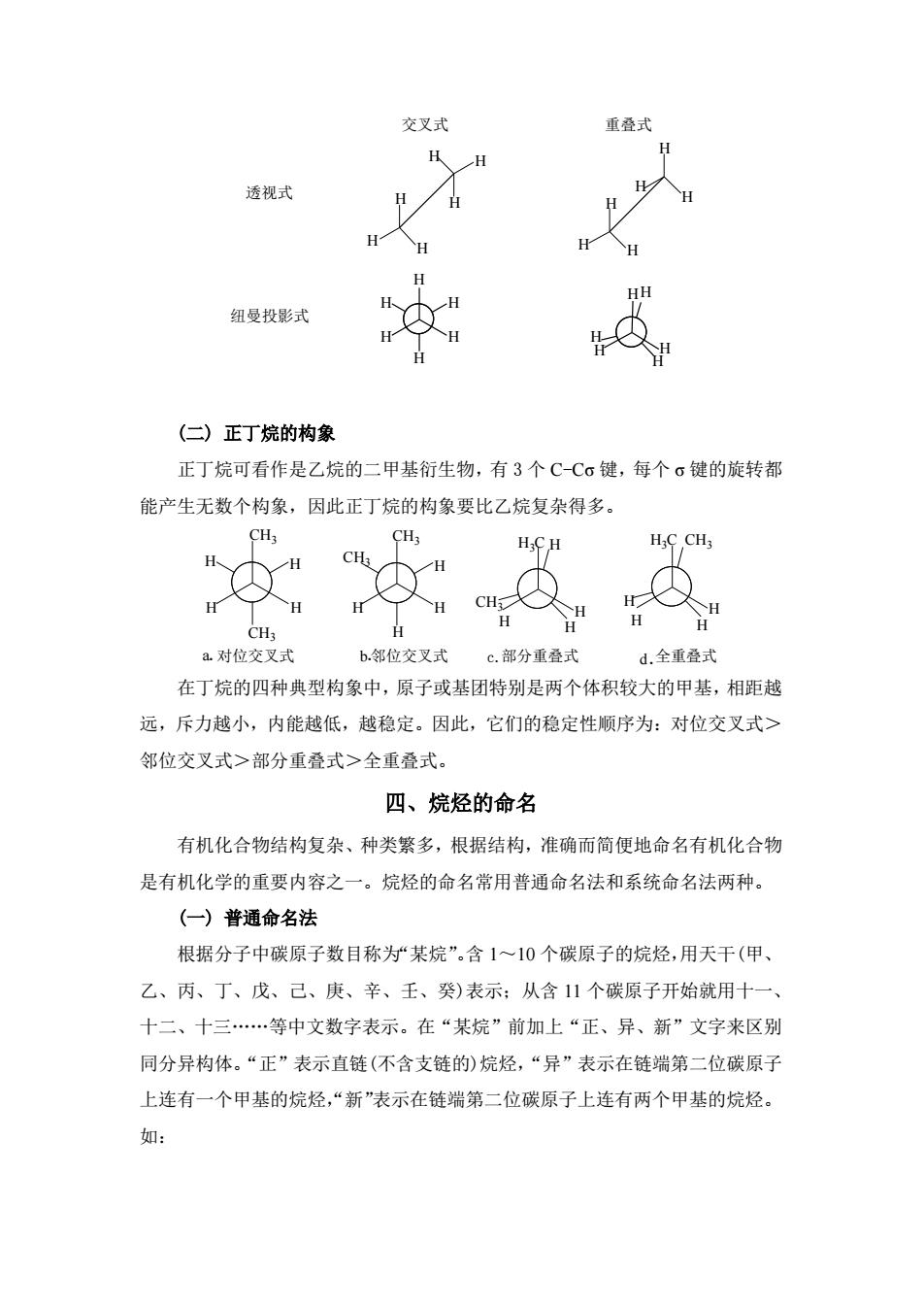
种碳链异构体。 CH3 CH3-CH2-CH2-CH3 CH3-CH-CH3 CH3 CH;-CH-CH2-CH3 CH3-C-CH3 像这种分子组成相同,分子中原子间连接的顺序或方式不同而引起的同分异 构现象,称为构造异构。碳链异构是构造异构的一种。 2碳原子和氢原子的类型烷烃分子中的碳原子根据与它直接结合的碳原 子数目多少的不同可分为4种:只与一个碳原子直接相连的碳原子,称为伯碳原 子或称一级碳原子,常用1°表示(如下式中的C1、C、C6、C,和C):与两个 碳原子直接相连的碳原子,称为仲碳原子或称二级碳原子,常用2°表示(如下 式中的C):与三个碳原子直接相连的碳原子,称为叔碳原子或称三级碳原子, 常用3°表示(如下式中的C3):与四个碳原子直接相连的碳原子,称为季碳原子 或称四级碳原子,常用4°表示(如下式中的C2) 'cH-℃-3CH-cH-cH TCH CH3 三、烷烃的构象异构 烷烃中的C-C键和C-H键都是。键。σ键的特点是能够绕对称轴旋转,而 不影响键的强度和键角。当烷烃分子中的C-Cσ键沿键轴旋转时,分子中的氢原 子或基团在空间的排列方式不断变化。这种因σ键的旋转而产生的分子的各种 立体形象称为构象。同一化合物的各种不同构象,称为构象异构体。 (一)乙烷的构象 乙烷是最简单的含有一个C-Cσ键的化合物。如果使乙烷中的一个碳原子不 动,另一个碳原子绕CC键轴旋转,可以产生无数个构象,其中交叉式和重叠 式是两种典型构象,可用透视式和纽曼(Newman)投影式表示
种碳链异构体。 CH3-CH2-CH2-CH3 CH3-CH-CH3 CH3 正丁烷 异丁烷 CH3CH2CH2CH2CH3 CH3-CH-CH2-CH3 CH3 CH3-C-CH3 CH3 CH3 像这种分子组成相同,分子中原子间连接的顺序或方式不同而引起的同分异 构现象,称为构造异构。碳链异构是构造异构的一种。 2.碳原子和氢原子的类型 烷烃分子中的碳原子根据与它直接结合的碳原 子数目多少的不同可分为 4 种:只与一个碳原子直接相连的碳原子,称为伯碳原 子或称一级碳原子,常用 1°表示(如下式中的 C1、C5、C6、C7 和 C8);与两个 碳原子直接相连的碳原子,称为仲碳原子或称二级碳原子,常用 2°表示(如下 式中的 C4);与三个碳原子直接相连的碳原子,称为叔碳原子或称三级碳原子, 常用 3°表示(如下式中的 C3);与四个碳原子直接相连的碳原子,称为季碳原子 或称四级碳原子,常用 4°表示(如下式中的 C2)。 1 CH3 2 C 3 CH 4 CH2 5 CH3 6 CH3 7 CH3 8 CH3 - - - - 三、烷烃的构象异构 烷烃中的 C-C 键和 C-H 键都是 σ 键。σ 键的特点是能够绕对称轴旋转,而 不影响键的强度和键角。当烷烃分子中的 C-Cσ 键沿键轴旋转时,分子中的氢原 子或基团在空间的排列方式不断变化。这种因 σ 键的旋转而产生的分子的各种 立体形象称为构象。同一化合物的各种不同构象,称为构象异构体。 (一) 乙烷的构象 乙烷是最简单的含有一个 C-C σ 键的化合物。如果使乙烷中的一个碳原子不 动,另一个碳原子绕 C-C 键轴旋转,可以产生无数个构象,其中交叉式和重叠 式是两种典型构象,可用透视式和纽曼(Newman)投影式表示
交叉式 重叠式 H 透视式 HH 纽曼投影式 (二)正丁烷的构象 正丁烷可看作是乙烷的二甲基衍生物,有3个CCσ键,每个。键的旋转都 能产生无数个构象,因此正丁烷的构象要比乙烷复杂得多 CH 出灯交 HsC CH T Ha a.对位交义式 b.邻位交叉式c.部分重叠式d.全重叠式 在丁烷的四种典型构象中,原子或基团特别是两个体积较大的甲基,相距越 远,斥力越小,内能越低,越稳定。因此,它们的稳定性顺序为:对位交叉式> 邻位交叉式>部分重叠式>全重叠式。 四、烷烃的命名 有机化合物结构复杂、种类繁多,根据结构,准确而简便地命名有机化合物 是有机化学的重要内容之一。烷烃的命名常用普通命名法和系统命名法两种。 (一)普通命名法 根据分子中碳原子数目称为某烷”。含1~10个碳原子的烷烃,用天干(甲、 乙、丙、丁、戊、己、庚、辛、王、癸)表示:从含11个碳原子开始就用十一 十二、十三.等中文数字表示。在“某烷”前加上“正、异、新”文字来区别 同分异构体。“正”表示直链(不含支链的)烷烃,“异”表示在链端第二位碳原子 上连有一个甲基的烷烃,“新”表示在链端第二位碳原子上连有两个甲基的烷烃。 如:
H H H H H H H H H H H H H H H H H H H H H H H H 交叉式 重叠式 透视式 纽曼投影式 (二) 正丁烷的构象 正丁烷可看作是乙烷的二甲基衍生物,有 3 个 C-Cσ 键,每个 σ 键的旋转都 能产生无数个构象,因此正丁烷的构象要比乙烷复杂得多。 CH3 H H CH3 H H a b c. d H3C CH3 H H H H CH3 CH3 H H H H H3C CH3 H H H H .对位交叉式 .邻位交叉式 部分重叠式 .全重叠式 在丁烷的四种典型构象中,原子或基团特别是两个体积较大的甲基,相距越 远,斥力越小,内能越低,越稳定。因此,它们的稳定性顺序为:对位交叉式> 邻位交叉式>部分重叠式>全重叠式。 四、烷烃的命名 有机化合物结构复杂、种类繁多,根据结构,准确而简便地命名有机化合物 是有机化学的重要内容之一。烷烃的命名常用普通命名法和系统命名法两种。 (一) 普通命名法 根据分子中碳原子数目称为“某烷”。含 1~10 个碳原子的烷烃,用天干(甲、 乙、丙、丁、戊、己、庚、辛、壬、癸)表示;从含 11 个碳原子开始就用十一、 十二、十三„„等中文数字表示。在“某烷”前加上“正、异、新”文字来区别 同分异构体。“正”表示直链(不含支链的)烷烃,“异”表示在链端第二位碳原子 上连有一个甲基的烷烃,“新”表示在链端第二位碳原子上连有两个甲基的烷烃。 如: