
原电池及电极电势 一、原电池 原电池(primary cell)是利用氧化还原反应,将化学能转化为电能的装置。最早发明的 原电池是铜-锌电池,称Daniell电池,其结构简图见下图。 电流计 n片 Cu片 Zn2/Zn半电池 Cu2*/Cu半电池 图铜锌原电池示煮图 (一)原电池的构成 如图81所示,左侧烧杯内为硫酸锌(ZSO4)溶液并插入锌片(Zn),称为锌电极或 锌半电池:右侧烧杯内为硫酸铜(CS04)溶液并插入铜片(Cu),称为铜电极或铜半电池。 两个烧杯用盐桥(倒置的U型管,内充饱和KC溶液与琼脂制成的凝胶,通过K和C向 两端扩散,能导通电流)连接,再用导线连接Z小片和Cu片,中间串联一个电流计,可以 观察到电流计的指针发生偏转的方向和大小,这表明导线中有电流通过。由电流计指针偏转 方向可知,电流从铜电极流向锌电极(电子从锌电极流向铜电极),亦即电流由正极流向负 极。 铜锌原电池中两极发生的反应(电极反应或半电池反应)为: 锌电极(负极):Zn-2cZn2+(氧化反应) 铜电极(正极):Cu2+2e户Cu(还原反应) 综上,电极反应的通式可写作: 氧化型+ne户还原型 Ox+ne Red 一个电极反应(electrode reaction)不能单独发生,只有两个半电池才能构成一个原电
原电池及电极电势 一、原电池 原电池(primary cell)是利用氧化还原反应,将化学能转化为电能的装置。最早发明的 原电池是铜-锌电池,称 Daniell 电池,其结构简图见下图。 图 铜-锌原电池示意图 (一)原电池的构成 如图 8-1 所示,左侧烧杯内为硫酸锌(ZnSO4)溶液并插入锌片(Zn),称为锌电极或 锌半电池;右侧烧杯内为硫酸铜(CuSO4)溶液并插入铜片(Cu),称为铜电极或铜半电池。 两个烧杯用盐桥(倒置的 U 型管,内充饱和 KCl 溶液与琼脂制成的凝胶,通过 K +和 Cl-向 两端扩散,能导通电流)连接,再用导线连接 Zn 片和 Cu 片,中间串联一个电流计,可以 观察到电流计的指针发生偏转的方向和大小,这表明导线中有电流通过。由电流计指针偏转 方向可知,电流从铜电极流向锌电极(电子从锌电极流向铜电极),亦即电流由正极流向负 极。 铜-锌原电池中两极发生的反应(电极反应或半电池反应)为: 锌电极(负极): - 2+ Zn - 2e Zn (氧化反应) 铜电极(正极): 2+ - Cu +2e Cu (还原反应) 综上,电极反应的通式可写作: - 氧化型 + ne 还原型 或: - Ox + ne Red 一个电极反应(electrode reaction)不能单独发生,只有两个半电池才能构成一个原电

池,两个电极反应相加即得电池反应(cell reaction): Zn +Cu"Zn2+Cu 由此可见,铜锌原电池装置发生的氧化、还原反应,和Z与Cu直接接触所发生的 氧化还原反应实质是一样的,只不过这种装置使化学能转化为了电能。 (二)原电池的表示方法 为了方便,原电池装置可以用电池组成式(电池符号)表示。例如铜锌原电池可表示 为 ()Zn(s)Zn2 (c)Cu"(ca)Cu(sX+) 式中,c1、2表示溶液浓度:s表示固体,也可不注明。 书写电池组成式的规定有以下几点, 1“|”表示两相界面,“川”表示盐桥,同一相中不同物质用“,”隔开,半电池中 溶液紧靠盐桥,电极远离盐桥: 2.一般负极()写在盐桥左边,正极()写在右边: 3.电池中各物质状态(g、【、s)和温度、浓度、分压用括号在后面注明。如无注明,则表 示温度为298.15K,溶液浓度为1.0molL,气体分压为101.325kPa: 4.若半电池中无金属单质作电极导体,需用惰性电极(一种能导电而不参加反应的电极, 如石墨、铂)作为导体。 【例】将下列氧化还原反应设计成原电池: MnO +5Fe*++5Fe"+4H.O 写出所设计原电池的正、负极反应、电池组成式。 解:根据正极发生还原反应,负极发生氧化反应,将上述氧化还原反应拆成两个半反应: 正极对应反应:MnO:+8H+5e=Mn2“+4H0 负极对应反应:Fe2-e≠Fe” 因为反应物中没有可作电极导体的物质,需加入惰性电极P1作为导体,故此原电池组 成式为: (-)PtFe(Ci).Fe2(ca)MnOj(ca).Mn2(C4).H'(Cs)Pt(+)
池,两个电极反应相加即得电池反应(cell reaction): 2+ 2+ Zn +Cu Zn +Cu 由此可见,铜-锌原电池装置发生的氧化、还原反应,和 Zn 与 Cu2+直接接触所发生的 氧化还原反应实质是一样的,只不过这种装置使化学能转化为了电能。 (二)原电池的表示方法 为了方便,原电池装置可以用电池组成式(电池符号)表示。例如铜-锌原电池可表示 为: 2+ 2+ ( ) Zn(s) ( ) Cu - c + Zn ( ) c1 Cu 2 (s)( ) 式中,c1、c2表示溶液浓度;s 表示固体,也可不注明。 书写电池组成式的规定有以下几点: 1.“∣”表示两相界面,“||”表示盐桥,同一相中不同物质用“,”隔开,半电池中 溶液紧靠盐桥,电极远离盐桥; 2.一般负极()写在盐桥左边,正极()写在右边; 3.电池中各物质状态(g、l、s)和温度、浓度、分压用括号在后面注明。如无注明,则表 示温度为 298.15K,溶液浓度为 1.0 mol·L-1,气体分压为 101.325 kPa; 4.若半电池中无金属单质作电极导体,需用惰性电极(一种能导电而不参加反应的电极, 如石墨、铂)作为导体。 【例】 将下列氧化还原反应设计成原电池: 2 2+ + 2+ 3+ 4 MnO +5Fe +8H Mn +5Fe +4H O 写出所设计原电池的正、负极反应、电池组成式。 解:根据正极发生还原反应,负极发生氧化反应,将上述氧化还原反应拆成两个半反应: 正极对应反应: 2 + 2+ 4 - MnO +8H +5e Mn +4H O 负极对应反应: 2+ 3+ - Fe - e Fe 因为反应物中没有可作电极导体的物质,需加入惰性电极 Pt 作为导体,故此原电池组 成式为: 2+ 2+ + 4 3+ ( ) Pt Fe Pt ( ) ( ),Fe ( ) MnO ( ),Mn ( ),H ( ) - + c c c c c 1 2 3 4 5

二、电极电势 铜锌原电池中,通过电流计指针的偏转方向,可判断出电流从铜电极流向锌电极,说 明两个电极的电势不等,之间存在电势差。 (一)电极电势的产生 电极电势的产生主要与金属电极及其盐溶液之间的相互作用有关。金属电极表面有自由 电子和金属阳离子,当金属电极浸入其盐溶液中时,则会出现两种倾向:一种是电极表面的 金属离子在溶剂分子及阴离子的作用下进入溶液中,而电子留在电极上,这个过程称为“溶 解”:另一种是溶液中的金属离子受电极表面电子的吸引而沉积在电极表面上,这个过程称 为沉积”。当金属的溶解速率与金属离子的沉积速率相等时,则达到动态平衡: M()M"(aq)tne 沉积 若金属溶解的倾向大于沉积的倾向,当达平衡时,金属电极表面留有较多电子而带负电 荷。由于静电作用,溶液中带正电荷的离子就会靠近电极,于是形成如图()所示的双电 层。若金属沉积的倾向大于溶解的倾向,当达到平衡时,金属表面沉积了较多的金属离子而 带正电荷,溶液中的负离子就会靠近电极,于是形成如图(b)所示的双电层。无论哪种双 电层,金属电极表面与其盐溶液之间都会产生电势差,这种电势差称为该金属的平衡电极电 势,简称电极电势。可用MM表示,单位是伏特(V)。 M (a) (b) 图金属电极的电极电势 电极电势的高低与溶液的温度、溶液中金属离子的浓度等因素有关,但主要取决于金 属本身的活泼性。金属越活泼,溶解的倾向越大,离子沉积的倾向越小,达到平衡时,该金 属电极电势越低:反之,金属越不活泼,该金属电极电势越高。 由于不同的电极具有不同的电极电势,若将两个不同的电极组成原电池,原电池就可 以产生电流,其中电极电势高的一方为正极,电极电势较低的为负极。在没有电流通过的情 况下,正、负两极的电极电势之差称为原电池的电动势,用符号E表示
二、电极电势 铜-锌原电池中,通过电流计指针的偏转方向,可判断出电流从铜电极流向锌电极,说 明两个电极的电势不等,之间存在电势差。 (一)电极电势的产生 电极电势的产生主要与金属电极及其盐溶液之间的相互作用有关。金属电极表面有自由 电子和金属阳离子,当金属电极浸入其盐溶液中时,则会出现两种倾向:一种是电极表面的 金属离子在溶剂分子及阴离子的作用下进入溶液中,而电子留在电极上,这个过程称为“溶 解”;另一种是溶液中的金属离子受电极表面电子的吸引而沉积在电极表面上,这个过程称 为“沉积”。当金属的溶解速率与金属离子的沉积速率相等时,则达到动态平衡: n+ - M(s) M (aq)+ne 溶解 沉积 若金属溶解的倾向大于沉积的倾向,当达平衡时,金属电极表面留有较多电子而带负电 荷。由于静电作用,溶液中带正电荷的离子就会靠近电极,于是形成如图(a)所示的双电 层。若金属沉积的倾向大于溶解的倾向,当达到平衡时,金属表面沉积了较多的金属离子而 带正电荷,溶液中的负离子就会靠近电极,于是形成如图(b)所示的双电层。无论哪种双 电层,金属电极表面与其盐溶液之间都会产生电势差,这种电势差称为该金属的平衡电极电 势,简称电极电势。可用(Mn+/M)表示,单位是伏特(V)。 M M Mn+ Mn+ + + + + + + + + + + + + + + + + + + + + _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ (a) (b) 图 金属电极的电极电势 电极电势的高低与溶液的温度、溶液中金属离子的浓度等因素有关,但主要取决于金 属本身的活泼性。金属越活泼,溶解的倾向越大,离子沉积的倾向越小,达到平衡时,该金 属电极电势越低;反之,金属越不活泼,该金属电极电势越高。 由于不同的电极具有不同的电极电势,若将两个不同的电极组成原电池,原电池就可 以产生电流,其中电极电势高的一方为正极,电极电势较低的为负极。在没有电流通过的情 况下,正、负两极的电极电势之差称为原电池的电动势,用符号 E 表示

E=o'-p 式中,叶为正极的电极电势,?为负极的电极电势。 (二)标准氢电极 电极电势的大小,反映了金属电极的活泼性,即电极电对得失电子的难易。但目前电极 电势的绝对值仍无法测量,只能通过选其他特定电极作为比较标准,确定相对值。通常,采 用标准氢电极(standard hydrogen,SHE)作为此较标准。标准氢电极如下图所示, 即将镀有一层多孔铂黑(P1)的铂片浸入H浓度为1.0molL的盐酸溶液中,在温度为 298.15K时,不断通入分压为101.325kPa的纯氢气,使铂黑吸附氢气达到饱和。 一632n Imol-L-HCI 图标准氢电极 该状态下,电极表面H,与溶液中H达到动态平衡(电极反应): 2H'(aq)+2e H2 此时,被氢气饱和了的铂片和溶液之间所产生的电势差就是标准氢电极的电极电势,其 值为零。 规定在298.15K时,标准氢电极的电极电势为零,即pHH20.0000V (三)标准电极电势 标准电极电势是指标准状态(温度为298.15K,有关气体气压为101.325kPa,组成电极 的离子浓度为l.0molL下电极的电势,用符号°(Ox/Red)表示。欲测定某给定电极的标 准电极电势,可将待测标准电极与标准氢电极组成原电池(标准氢电极待测标准电极),然 后通过实验测定电池电动势E”,最后根据E=®,一Q卿可求出给定电极的标准电极电势。 例如,测定铜电极的标准电势(Cu/C),可将标准铜电极与标准氢电极组成原电池, 如图84所示:
+ E= - - 式中,+ 为正极的电极电势,-为负极的电极电势。 (二)标准氢电极 电极电势的大小,反映了金属电极的活泼性,即电极电对得失电子的难易。但目前电极 电势的绝对值仍无法测量,只能通过选其他特定电极作为比较标准,确定相对值。通常,采 用标准氢电极(standard hydrogen electrode, SHE)作为比较标准。标准氢电极如下图所示, 即将镀有一层多孔铂黑(Pt)的铂片浸入 H +浓度为 1.0 molL -1 的盐酸溶液中,在温度为 298.15K 时,不断通入分压为 101.325kPa 的纯氢气,使铂黑吸附氢气达到饱和。 金属Pt 101.325kPa 纯H2 1mol L -1 HCl 图 标准氢电极 该状态下,电极表面 H2 与溶液中 H +达到动态平衡(电极反应): + - 2H (aq)+2e H2 此时,被氢气饱和了的铂片和溶液之间所产生的电势差就是标准氢电极的电极电势,其 值为零。 规定在 298.15K 时,标准氢电极的电极电势为零,即 (H+ /H2)=0.0000V。 (三)标准电极电势 标准电极电势是指标准状态(温度为 298.15K,有关气体气压为 101.325kPa,组成电极 的离子浓度为 1.0 molL -1)下电极的电势,用符号 (Ox/Red)表示。欲测定某给定电极的标 准电极电势,可将待测标准电极与标准氢电极组成原电池( 标准氢电极 待测标准电极 ),然 后通过实验测定电池电动势 E ,最后根据 E =+ -- 即可求出给定电极的标准电极电势。 例如,测定铜电极的标准电势 (Cu2+/Cu),可将标准铜电极与标准氢电极组成原电池, 如图 8-4 所示:
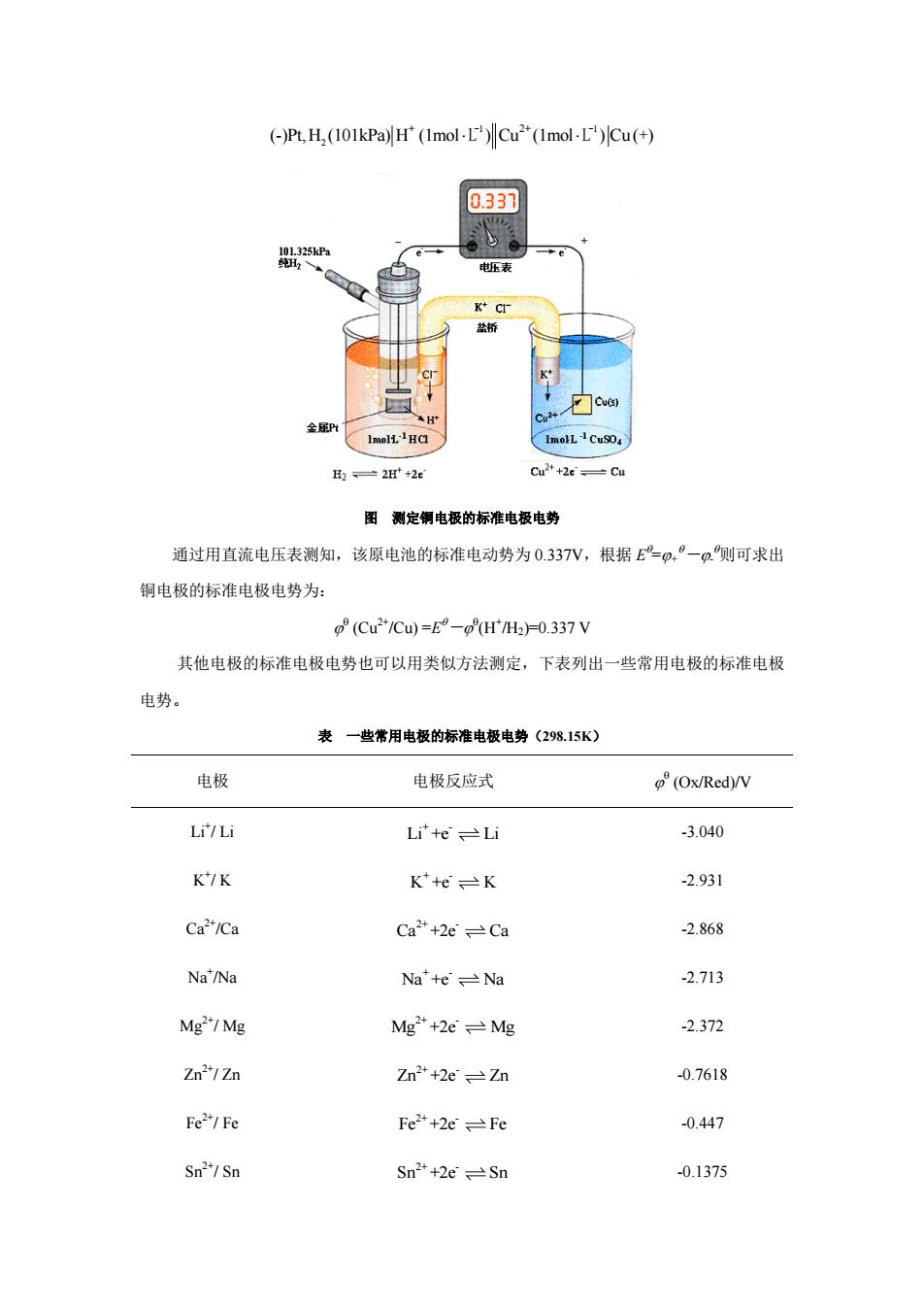
(-)Pt,H,(101kPa)H'(Imol-LCu2(Imol-L)Cu(+) 0.337 一2+2 图测定铜电极的标准电极电势 通过用直流电压表测知,该原电池的标准电动势为0.337V,根据=.°一Q则可求出 铜电极的标准电极电势为: (Cu2*1Cu=E9-H0.337V 其他电极的标准电极电势也可以用类似方法测定,下表列出一些常用电极的标准电极 电势。 一些常用电极的标准电极电势(298.15K) 电极 电极反应式 (Ox/Red)/V Li/Li Li'teLi -3.040 K/K K'+eK -2.931 Ca/Ca Ca"+2eCa 2.868 Na'/Na Na'+eNa 2.713 Mg/Mg Mg"+2eMg 2.372 Zn2/Zn Zn"+2eZn 0.7618 Fe/Fe Fe2+2eFe 0447 Sn/Sn 01375
2 + 2+ (-)Pt, H (101kPa) H (1mol ) Cu (1mol ) Cu ( ) -1 -1 L L + 图 测定铜电极的标准电极电势 通过用直流电压表测知,该原电池的标准电动势为 0.337V,根据 E =+ -- 则可求出 铜电极的标准电极电势为: (Cu2+/Cu) =E - (H+ /H2)=0.337 V 其他电极的标准电极电势也可以用类似方法测定,下表列出一些常用电极的标准电极 电势。 表 一些常用电极的标准电极电势(298.15K) 电极 电极反应式 (Ox/Red)/V Li+ / Li + - Li +e Li -3.040 K + / K + - K +e K -2.931 Ca 2+/Ca 2+ - Ca +2e Ca -2.868 Na+ /Na + - Na +e Na -2.713 Mg2+/ Mg 2+ - Mg +2e Mg -2.372 Zn2+/ Zn 2+ - Zn +2e Zn -0.7618 Fe2+/ Fe 2+ - Fe +2e Fe -0.447 Sn2+/ Sn 2+ - Sn +2e Sn -0.1375