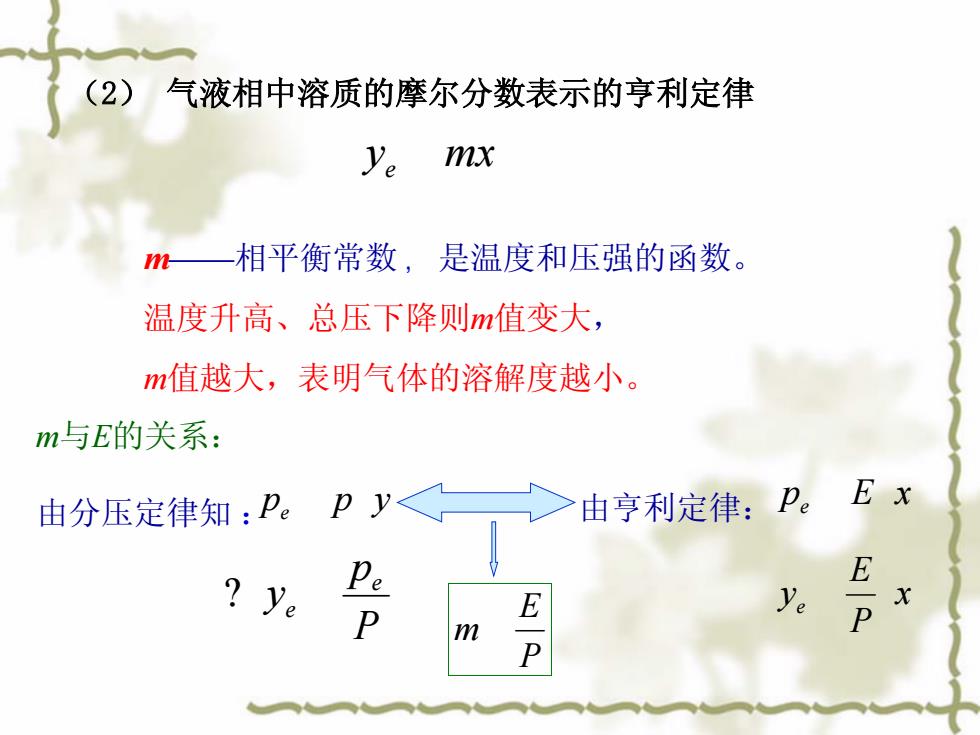
(2)气液相中溶质的摩尔分数表示的亨利定律 ye mx 相平衡常数,是温度和压强的函数。 温度升高、总压下降则m值变大, m值越大,表明气体的溶解度越小。 m与E的关系: 由分压定律知:Pe > 由亨利定律:P。Ex Pe E ye ye D
(2) 气液相中溶质的摩尔分数表示的亨利定律 y mx e m——相平衡常数 ,是温度和压强的函数。 温度升高、总压下降则m值变大, m值越大,表明气体的溶解度越小。 m与E的关系: p p y 由分压定律知 : e P p y e e p E x 由亨利定律: e x P E ye P E m

例:在常压及20℃下,测得氨在水中的平衡数据为:浓度 为0.5gNH3/100gH2O的稀氨水上方的平衡分压为400Pa,在该 浓度范围下相平衡关系可用亨利定律表示,试求亨利系 数E,溶解度系数H,及相平衡常数m。(氨水密度可取 为1000kg/m3) 懈亨利定律表达式知: 卫e 0.5/17 X 0.00527 0.5/17100/18
例:在常压及20℃下,测得氨在水中的平衡数据为:浓度 为0.5gNH3/100gH2O的稀氨水上方的平衡分压为400Pa,在该 浓度范围下相平衡关系可用亨利定律表示,试求亨利系 数E,溶解度系数H,及相平衡常数m。(氨水密度可取 为1000kg/m3 ) 解:由亨利定律表达式知: x p E e 0.5/17 100 /18 0.5/17 x 0.00527

Pe 400 亨利系数为 E X 0.00527 7.59u104Pa 又yemx,而。 Pe 400 0.00395 1.010105 0.00395 相平衡常数 m 0.75 0.00527 E 7.590104 m 0.749 P 101.330103
∴亨利系数为 x p E e 0.00527 400 Pa 4 7.5910 又 y mx e ,而 P p y e e 5 1.01 10 400 0.00395 ∴相平衡常数 0.00527 0.00395 m 0.75 P E m 3 4 101.33 10 7.59 10 0.749

。cH 0.5/17 0.5100 1000 .溶解度系数为: H 400 1.365010 Pa m'/kmol 0.293 或由各系数间的关系求出其它系数 H EM 7.590104018 1.3660103 m Palkmol Y 1000
∴溶解度系数为: H 1.365 10 Pa m / kmol 0.293 400 3 3 或由各系数间的关系求出其它系数 s EMs H 1000 7.59 10 18 4 1.366 10 m Pa / kmol 3 3 pe cH 1000 0.5 100 0.5 /17 c

8.2.2相平衡与吸收过程的关系 x=0.05 1、判断传质进行的方向 y=0.1 含氨气体 例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为: 0.94x,若含氨0.094摩尔分数的混合气和组成x0.05 的氨水接触,确定过程的方向。 解: 用相平衡关系确定与实际气相组成y0.094 成平衡的液相组成 x。y/0.94 0.1!0.05 .气液相接触时,氨将从气相转入液相,发生吸收过程
8.2.2 相平衡与吸收过程的关系 1、判断传质进行的方向 例:在101.3kPa,20℃下,稀氨水的气液相平衡关系为 : y x e 0.94 ,若含氨0.094摩尔分数的混合气和组成 x 0.05 的氨水接触,确定过程的方向。 解: 用相平衡关系确定与实际气相组成 y 0.094 成平衡的液相组成 x y / 0.94 e 0.1 0.05 ∴气液相接触时,氨将从气相转入液相,发生吸收过程