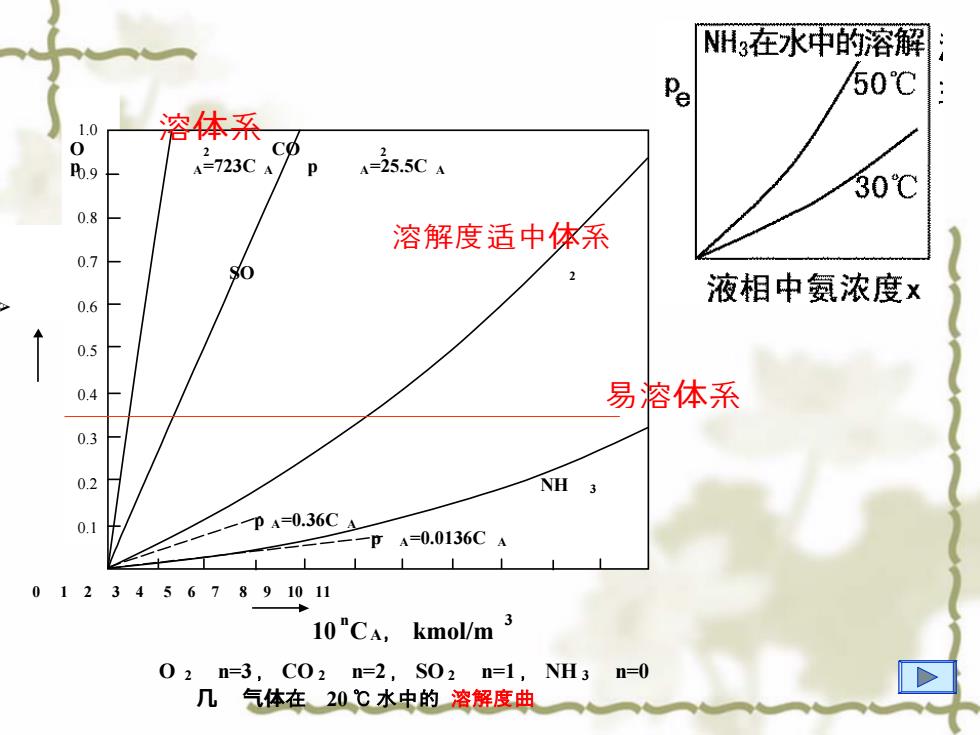
NH在水中的溶解 Pe 50℃ 1.0 溶体系 0 b.9 A=723C A A-25.5CA 30℃ 0.8 溶解度适中体系 0.7 SO 液相中氨浓度x 0.6 0.5 0.4 易溶体系 0.3 0.2 NH 3 0.1 一pA=0.36CA -一pA=0.0136C4 01234567891011 10"CA,kmol/m 3 02n=3,C02n=2,S02n=1,NH3n=0 几气体在20℃水中的溶解度曲
1.0 0.9 0.8 0.7 0.6 0.5 0.4 0.3 0.2 0.1 p , A at m O 2 CO 2 p A=723C A p A=25.5C A SO 2 NH 3 p A=0.36C A p A=0.0136C A 0 1 2 3 4 5 6 7 8 9 10 11 10 n CA,kmol/m 3 O 2 n=3 , CO 2n=2 , SO 2 n=1 ,NH 3 n=0 几�气体在 20℃ 水中的 溶解度曲� 溶体系 易溶体系 溶解度适中体系

说明 吸收剂、温度T、P一定时,不同物质的溶解度不同。 •对于同一种气体,分压一定时,温度T越高,溶解度越小。 •对于同一种气体,温度T一定时,分压P越大,溶解度越大。 •加压和降温对吸收操作有利
•吸收剂、温度T、P 一定时,不同物质的溶解度不同。 •对于同一种气体,分压一定时,温度T越高,溶解度越小。 •对于同一种气体,温度T一定时,分压P越大,溶解度越大。 •加压和降温对吸收操作有利。 说明

亨利定律 1、亨利定律 Pe Ex E一亨利常数,单位与压强单位一致。 E值取决于物系的特性及温度;温度T上升,E值增大: 在同一溶剂中,E值越大的气体越难溶
二、亨利定律 1、亨利定律 p Ex e E——亨利常数,单位与压强单位一致 。 E值取决于物系的特性及温度;温度T上升,E值增大; 在同一溶剂中,E值越大的气体越难溶

2、亨利定律的其他表示形式 (1)用溶质A在溶液中的摩尔浓度和气相中的分压表示的 亨利定律 p。cH H一溶解度系数,单位:kPam/kmol。 H是温度的函数,H值随温度升高而升高。 易溶气体H值小,难溶气体H值大
pe cH H——溶解度系数 ,单位:kPa·m3 /kmol。 H是温度的函数,H值随温度升高而升高。 易溶气体H值小,难溶气体H值大。 2、亨利定律的其他表示形式 (1)用溶质A在溶液中的摩尔浓度和气相中的分压表示的 亨利定律

H与E的关系 设溶液的密度为Ym(kg/m),浓度为cr(mol/m),则 Y Cm Mm M MXA Msxs E HCm Yn H Mm 对于稀溶液:Mm|Ms,Y|Y E Y:H M
H与E的关系 设溶液的密度为 ( / ) 3 m kg m ,浓度为 ( / ) 3 cM kmol m ,则 m m m M c m A A S S M M x M x Mm MS m S , E Hcm H Mm m 对于稀溶液: H M E s s