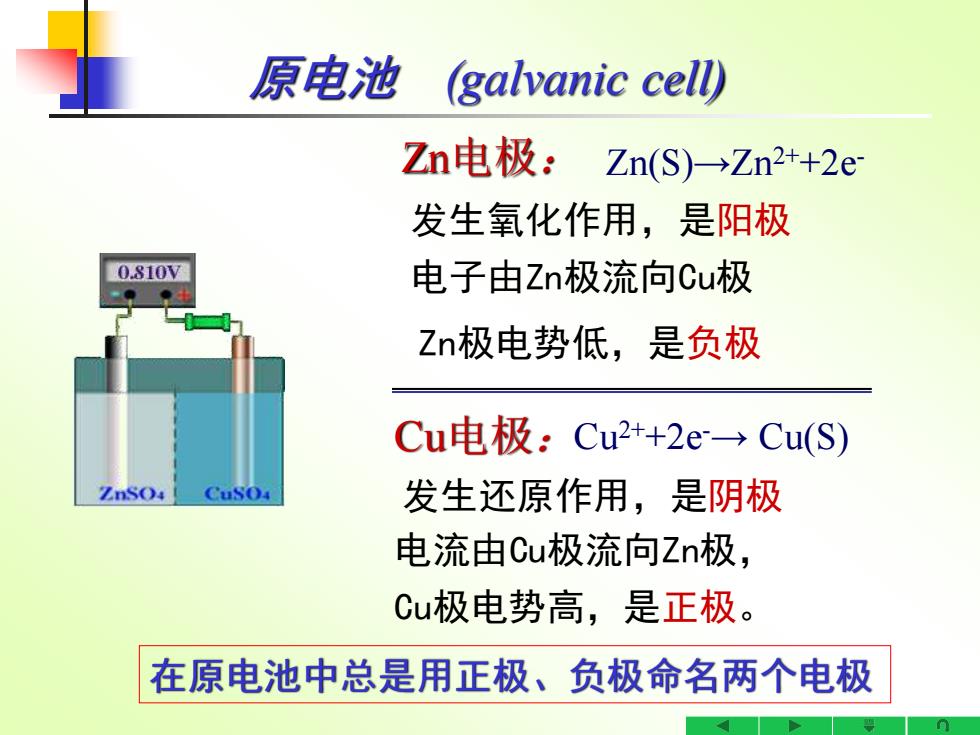
原电池 (galvanic cell) Zn电极:Zn(S)→Zn2+2e 发生氧化作用,是阳极 0.810V 电子由Zn极流向Cu极 Zn极电势低,是负极 Cu电极:Cu2++2e→Cu(S) CuSO 发生还原作用,是阴极 电流由Cu极流向Zn极, Cu极电势高,是正极。 在原电池中总是用正极、负极命名两个电极
发生还原作用,是阴极 Cu电极: Zn电极: 原电池 (galvanic cell) 在原电池中总是用正极、负极命名两个电极 Zn(S)→Zn2++2e- 发生氧化作用,是阳极 电子由Zn极流向Cu极 Zn极电势低,是负极 Cu2++2e-→ Cu(S) Cu极电势高,是正极。 电流由Cu极流向Zn极
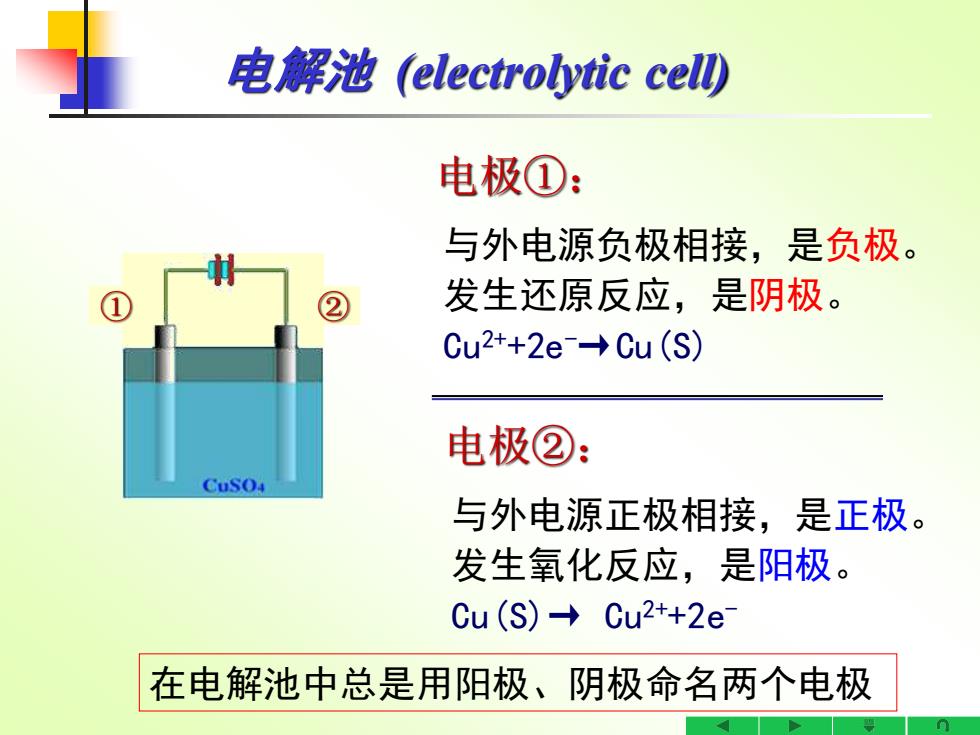
电,解池electrolytic cel) 电极①: 与外电源负极相接,是负极。 ② 发生还原反应,是阴极。 Cu2*+2e→Cu(S) 电极②: CuSO 与外电源正极相接,是正极。 发生氧化反应,是阳极。 Cu(S)→Cu2+2e 在电解池中总是用阳极、阴极命名两个电极
与外电源正极相接,是正极。 发生氧化反应,是阳极。 Cu(S)→ Cu2++2e- 电极②: 与外电源负极相接,是负极。 发生还原反应,是阴极。 Cu2++2e-→Cu(S) 电极①: ① ② 电解池 (electrolytic cell) 在电解池中总是用阳极、阴极命名两个电极

原电池和电解池的比较
原电池和电解池的比较

电化学反应与化学反应的区别 ◆一般情况下是氧化-一 还原的反应才能构 成电池(原电池或电解池) ◆化学反应过程中氧化剂与还原剂直接接触交 换电子而发生反应 ◆电化学反应中电子交换是间接的,氧化剂与 还原剂在不同场所(不同电极上)交换电子而 发生反应
化学反应过程中氧化剂与还原剂直接接触交 换电子而发生反应 电化学反应与化学反应的区别 一般情况下是氧化 -还原的反应才能构 成电池(原电池或电解池) 电化学反应中电子交换是间接的,氧化剂与 还原剂在不同场所(不同电极上)交换电子而 发生反应

法拉第定律的文字表述 Faraday's Law 1.在电极界面上发生化学变化物质的质量 与通入的电量成正比。 2.通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比
法拉第定律的文字表述 Faraday’s Law ⒈ 在电极界面上发生化学变化物质的质量 与通入的电量成正比。 ⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比