
导航 微思考1哪些物质中容易形成氢键? 提示:氢键普遍存在于已经与N、O、F等电负性很大的原子 形成共价键的氢原子与另外的N、O、F等电负性很大的原 子之间。所以氢键一般存在于含N一H、H一O、H一F的分 子间,或有机化合物中的醇类和羧酸类等物质的分子间
导航 微思考1哪些物质中容易形成氢键? 提示:氢键普遍存在于已经与N、O、F等电负性很大的原子 形成共价键的氢原子与另外的N、O、F等电负性很大的原 子之间。所以氢键一般存在于含N—H、H—O、H—F的分 子间,或有机化合物中的醇类和羧酸类等物质的分子间
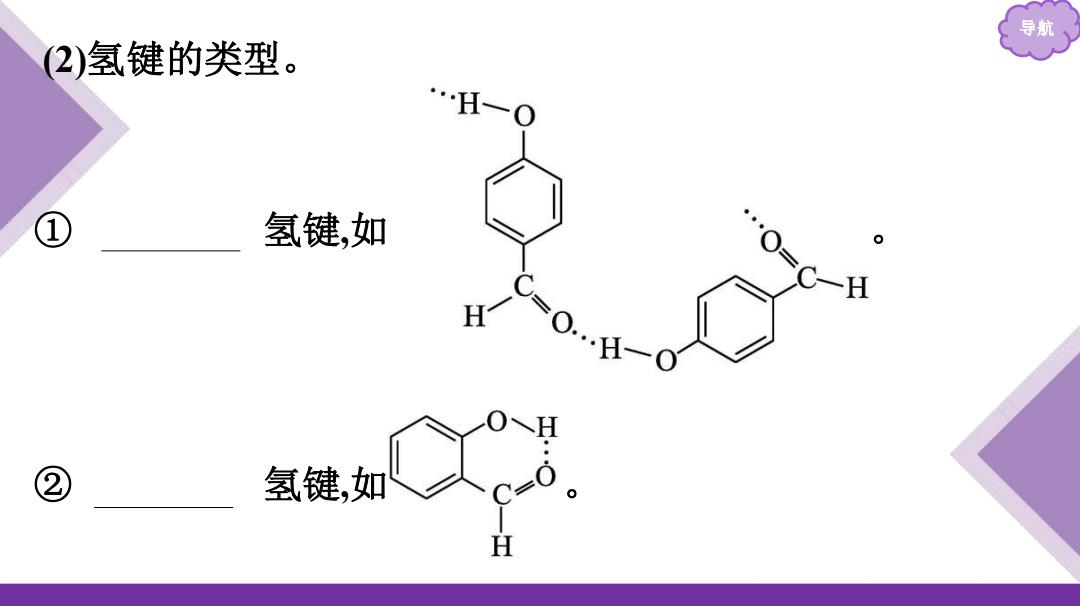
导航 2)氢键的类型。 …H一 ① 氢键,如 ”··○=C- H =○··.于—● ② 氢键,如 H
导航 (2)氢键的类型 。 ① 分子间 氢键,如 。 ② 分子内 氢键,如

导期 3)氢键对物质性质的影响。 ①当形成 氢键时,物质的熔、沸点较高。 ②当形成 氢键时,物质的熔、沸点较低。 ③氢键也影响物质的电离、溶解等过程。 微思考2范德华力、氢键、共价键的强弱都能影响分子的稳 定性吗? 提示:范德华力、氢键不影响分子的稳定性。共价键的强弱 影响分子的稳定性
导航 (3)氢键对物质性质的影响。 ①当形成 分子间 氢键时,物质的熔、沸点较高。 ②当形成 分子内 氢键时,物质的熔、沸点较低。 ③氢键也影响物质的电离、溶解等过程。 微思考2范德华力、氢键、共价键的强弱都能影响分子的稳 定性吗? 提示:范德华力、氢键不影响分子的稳定性。共价键的强弱 影响分子的稳定性
导航 3.溶解性。 1)“相似相溶”规律。 非极性溶质一般能溶于 溶剂,极性溶质一般能溶 于 溶剂。如蔗糖和氨 溶于水, 溶于四 氯化碳;萘和碘 溶于四氯化碳, 溶于水
导航 3.溶解性。 (1)“相似相溶”规律。 非极性溶质一般能溶于 非极性 溶剂,极性溶质一般能溶 于 极性 溶剂。如蔗糖和氨 易 溶于水, 难 溶于四 氯化碳;萘和碘 易 溶于四氯化碳, 难 溶于水

导月 (2)影响物质溶解性的因素。 ①外界因素:主要有 等。 ②氢键:溶剂和溶质之间的氢键相互作用力越大,溶解性越 (填“好”或“差”)。 ③分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越 如乙醇与水 ,而戊醇在水中的 溶解度明显较小。 ④溶质是否与水反应:溶质与水发生反应,溶质的溶解度会 。如S02与水反应生成的H,S03可溶于水,故S02的溶 解度
导航 (2)影响物质溶解性的因素。 ①外界因素:主要有 温度 、 压强 等。 ②氢键:溶剂和溶质之间的氢键相互作用力越大,溶解性越 好 (填“好”或“差”)。 ③分子结构的相似性:溶质和溶剂的分子结构相似程度越大, 其溶解性越 好 。如乙醇与水 互溶 ,而戊醇在水中的 溶解度明显较小。 ④溶质是否与水反应:溶质与水发生反应,溶质的溶解度会 增大 。如SO2与水反应生成的H2SO3可溶于水,故SO2的溶 解度 增大