
全程设计 第2课时 杂化轨道理论简介
第2课时 杂化轨道理论简介
课前·基础认知 课堂·重难突破 随堂训练
课前·基础认知 课堂·重难突破 随堂训练

导航 课前·基础认知 一、 杂化轨道理论 1.用杂化轨道理论解释甲烷分子的形成。 当碳原子与4个氢原子形成CH分子时,碳原子的 轨道和3 个 轨道发生混杂,形成4个能量相同、方向不同的 杂化轨道。4个 杂化轨道分别与4个氢原子的1s 轨道重叠,形成4个C一Hσ键
导航 课前·基础认知 一、杂化轨道理论 1.用杂化轨道理论解释甲烷分子的形成。 当碳原子与4个氢原子形成CH4分子时,碳原子的 2s 轨道和3 个 2p 轨道发生混杂,形成4个能量相同、方向不同的 sp3 杂化轨道。4个 sp3 杂化轨道分别与4个氢原子的1s 轨道重叠,形成4个C—H σ键
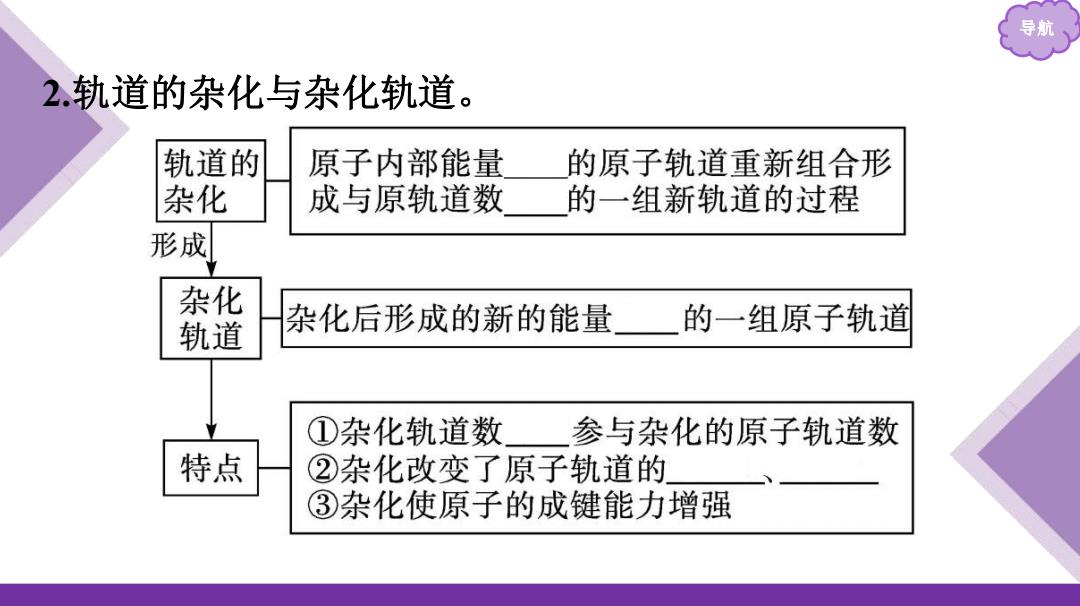
导航 2.轨道的杂化与杂化轨道。 轨道的 原子内部能量 的原子轨道重新组合形 杂化 成与原轨道数 的一组新轨道的过程 形成 杂化 轨道 杂化后形成的新的能量 的一组原子轨道 ①杂化轨道数 参与杂化的原子轨道数 特点 ②杂化改变了原子轨道的 ③杂化使原子的成键能力增强
导航 2.轨道的杂化与杂化轨道

导航 微思考1比较杂化轨道与参与杂化的原子轨道的异同点。 提示:杂化轨道与参与杂化的原子轨道相比较,数目相同,但能 量不同,轨道的方向不同
导航 微思考1比较杂化轨道与参与杂化的原子轨道的异同点。 提示:杂化轨道与参与杂化的原子轨道相比较,数目相同,但能 量不同,轨道的方向不同