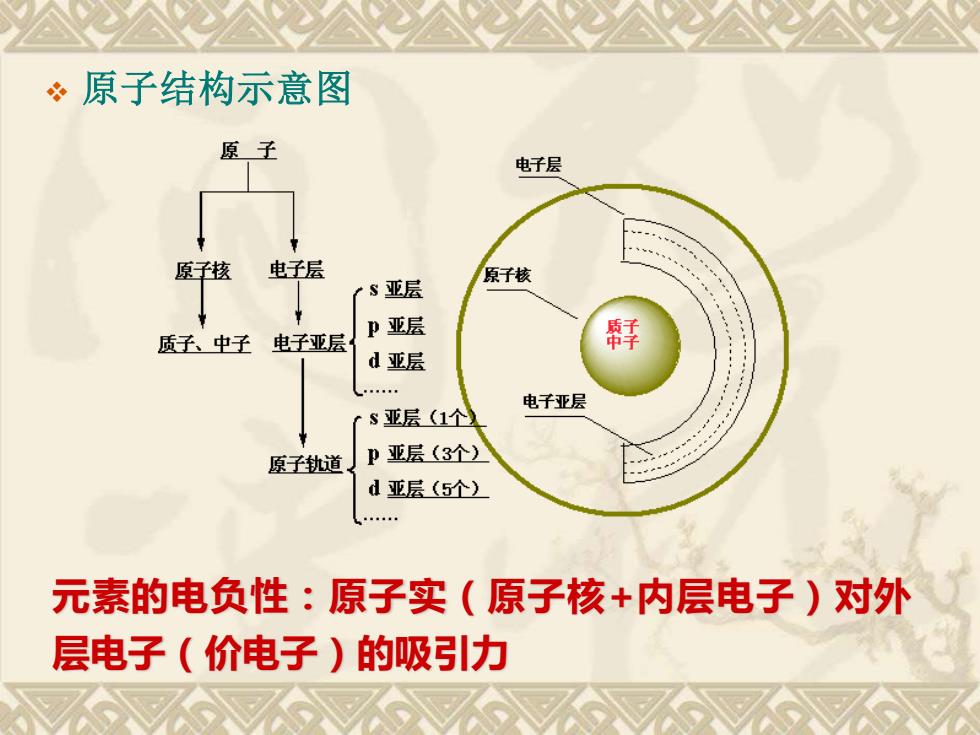
·原子结构示意图 原子 电子层 原子核 电子层 原子核 rs亚层 P亚层 质子、中子 电子亚层 d亚层 . 电子亚层 s亚层(1个) 原子轨道 P亚层(3个) d亚层(5个) 元素的电负性:原子实(原子核+内层电子)对外 层电子(价电子)的吸引力
❖ 原子结构示意图 元素的电负性:原子实(原子核+内层电子)对外 层电子(价电子)的吸引力
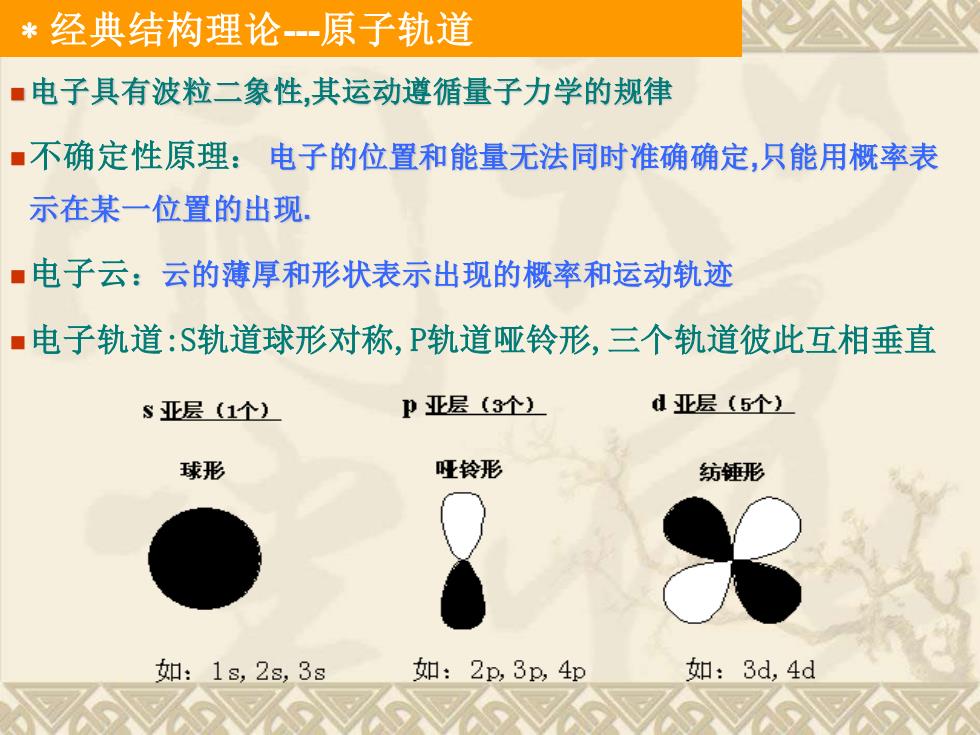
*经典结构理论一原子轨道 ■电子具有波粒二象性,其运动遵循量子力学的规律 ■不确定性原理:电子的位置和能量无法同时准确确定,只能用概率表 示在某一位置的出现: ·电子云:云的薄厚和形状表示出现的概率和运动轨迹 ■电子轨道:S轨道球形对称,P轨道哑铃形,三个轨道彼此互相垂直 S亚层(1个) P亚层(3个) d亚层(5个) 球形 哑铃形 纺锤形 如:1s,2s,3s 如:2p,3p,4p 如:3d,4d
经典结构理论-原子轨道 ◼电子具有波粒二象性,其运动遵循量子力学的规律 ◼不确定性原理: 电子的位置和能量无法同时准确确定,只能用概率表 示在某一位置的出现. ◼电子云:云的薄厚和形状表示出现的概率和运动轨迹 ◼电子轨道:S轨道球形对称,P轨道哑铃形,三个轨道彼此互相垂直

经典结构理论原子的电子排布规律 ▣八隅体 (Octet):原子总是倾向获得与惰性气体相同的价电 子排布 ■鲍里不相容原理:每个轨道最多只能容纳两个自旋相反配对 的电子 ■能量最低原理:电子尽可能占据能量最低的轨道 ■洪特规则:有几个简并轨道而又无足够的电子填充时,必须 在几个简并轨道逐一的各填充一个自旋平行的电子后,才能 容纳第二个电子
经典结构理论-原子的电子排布规律 ◼ 八隅体 (Octet):原子总是倾向获得与惰性气体相同的价电 子排布 ◼ 鲍里不相容原理: 每个轨道最多只能容纳两个自旋相反配对 的电子 ◼ 能量最低原理:电子尽可能占据能量最低的轨道 ◼ 洪特规则:有几个简并轨道而又无足够的电子填充时,必须 在几个简并轨道逐一的各填充一个自旋平行的电子后,才能 容纳第二个电子

*化学键 。化学键:将分子中的原子结合在一起的作用力称为化学键。 。共价键:两个或多个原子通过共用电子对而产生的一种化学 键称为共价键。电负性相差在0~0.6个单位之间形成共价键; 电负性相差在0.6~1.7个单位之间的形成极性共价键。共价键 有方向性和饱和性,共价键可以分为双原子共价键和多原子共 价键。 ÷金属键:使金属原子结合成金属晶体的化学键称之为金属键。 金属键无方向性和饱和性。 。离子键:依靠正、负离子间的静电引力而形成的化学键称为 离子键,又称为电价键。一般说来,两种原子电负性相差在 1.7个单位以上形成离子键
❖ 化学键:将分子中的原子结合在一起的作用力称为化学键。 ❖ 共价键:两个或多个原子通过共用电子对而产生的一种化学 键称为共价键。电负性相差在0~0.6个单位之间形成共价键; 电负性相差在0.6~1.7个单位之间的形成极性共价键。共价键 有方向性和饱和性,共价键可以分为双原子共价键和多原子共 价键。 ❖ 金属键:使金属原子结合成金属晶体的化学键称之为金属键。 金属键无方向性和饱和性。 ❖ 离子键:依靠正、负离子间的静电引力而形成的化学键称为 离子键,又称为电价键。一般说来,两种原子电负性相差在 1.7个单位以上形成离子键。 化学键

*化学键共价键 ·σ键:在化学上,将两个轨道沿着对称轴方向重叠形成 的键叫o键。o键的特点是()比较牢固;(i)o键能 围绕对称轴自由旋转()两个原子间形成。 π键:侧面交叠形成的键称为键。键的特点是() 容易断裂;(i)不能绕轴自由旋转(i)两个或多个原 子间形成。 ·配价键:共用电子对由一个原子提供的共价键称为共价 配键或配价键。用A→B表示,A是电子提供者,B是电 子接受者
❖ σ键:在化学上,将两个轨道沿着对称轴方向重叠形成 的键叫σ键。σ键的特点是(i)比较牢固;(ii)σ键能 围绕对称轴自由旋转(ⅲ)两个原子间形成。 ❖ π键:侧面交叠形成的键称为π键。π键的特点是(i) 容易断裂;(ii)不能绕轴自由旋转(ⅲ)两个或多个原 子间形成。 ❖ 配价键:共用电子对由一个原子提供的共价键称为共价 配键或配价键。用A→B表示,A是电子提供者,B是电 子接受者。 化学键-共价键