
如果两个氢原子的电子自旋相同,随着核 间距的减小,两个原子核间电子出现的概率密 度降低,增大了两个原子核的排斥力,系统能 量逐渐升高,且比两个远离的氢原子能量高, 不能形成稳定的氢分子。 无机化学 (供药学类及医学检验专业用)
如果两个氢原子的电子自旋相同,随着核 间距的减小,两个原子核间电子出现的概率密 度降低,增大了两个原子核的排斥力,系统能 量逐渐升高,且比两个远离的氢原子能量高, 不能形成稳定的氢分子

国家规课 两个氢原子相互接近时原子轨道重叠示意图 (供药学类及医学检验专业用)
两个氢原子相互接近时原子轨道重叠示意图

二、 价键理论的基本要点 价键理论的基本要点是: (1)两个原子接近时,自旋方式相反的未成对 电子可以配对形成共价键。 (2)一个原子含有几个未成对电子,通常就能 与其他原子的几个自旋方式相反的未成对电子配对 形成共价键。一个原子所形成的共价键的数目,受 未成对电子数目的限制,这就是共价键的饱和性。 (3)成键的原子轨道重叠越多,两核间电子出 现的概率密度就越大,形成的共价键就越牢固。在 可能情况下,共价键总是沿着原子轨道最大重叠的 方向形成,这就是共价键的方向性。用
二、价键理论的基本要点 价键理论的基本要点是: (1)两个原子接近时,自旋方式相反的未成对 电子可以配对形成共价键。 (2)一个原子含有几个未成对电子,通常就能 与其他原子的几个自旋方式相反的未成对电子配对 形成共价键。一个原子所形成的共价键的数目,受 未成对电子数目的限制,这就是共价键的饱和性。 (3)成键的原子轨道重叠越多,两核间电子出 现的概率密度就越大,形成的共价键就越牢固。在 可能情况下,共价键总是沿着原子轨道最大重叠的 方向形成,这就是共价键的方向性
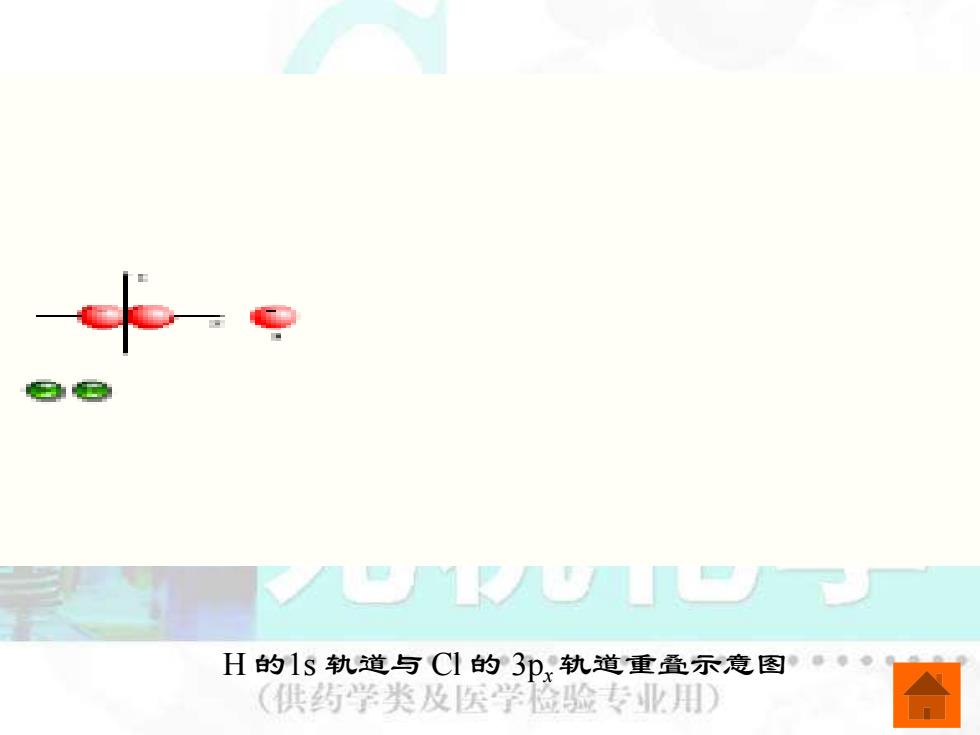
H的1s轨道与Cl的3p,轨道重叠示意图。· 供药学类及医学脸验专业用)
H 的1s 轨道与 Cl 的 3px 轨道重叠示意图

三、共价键的类型 (一))0键 原子轨道沿键轴(两原子核间联线)方向 以“头碰头”十方式重叠所形成的共价键称为 键。形成σ键时,原子轨道的重叠部分对于键 轴呈圆柱形对称,沿键轴方向旋转任意角度, 轨道的形状和符号均不改变。 无机化学 (供药学类及医学检验专业用)
三、共价键的类型 (一)σ键 原子轨道沿键轴(两原子核间联线)方向 以 “头碰头” 方式重叠所形成的共价键称为 σ键。形成σ键时,原子轨道的重叠部分对于键 轴呈圆柱形对称,沿键轴方向旋转任意角度, 轨道的形状和符号均不改变