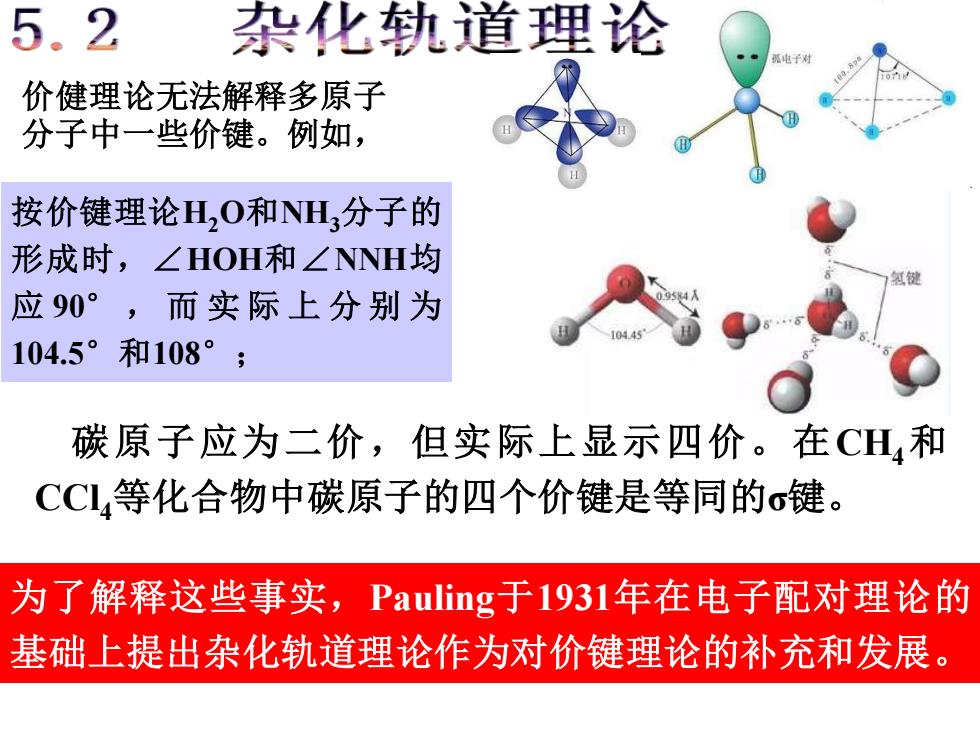
5.2 杂化轨道理论 价健理论无法解释多原子 分子中一些价键。例如, 按价键理论H,O和NH,分子的 形成时,∠HOH和∠NNH均 应90°,而实际上分别为 104.5°和108°; 碳原子应为二价,但实际上显示四价。在CH,和 CCL,等化合物中碳原子的四个价键是等同的σ键。 为了解释这些事实,Pauling于1931年在电子配对理论的 基础上提出杂化轨道理论作为对价键理论的补充和发展
按价键理论H2O和NH3分子的 形成时,∠HOH和∠NNH均 应 90° , 而 实 际 上 分 别 为 104.5°和108° ; 价健理论无法解释多原子 分子中一些价键。例如, 碳原子应为二价,但实际上显示四价。在CH4和 CCl4等化合物中碳原子的四个价键是等同的σ键。 为了解释这些事实,Pauling于1931年在电子配对理论的 基础上提出杂化轨道理论作为对价键理论的补充和发展

5.2杂化轨道理论 在周围原子作用下,根据原子的成键要求,将一 个原子中原有的原子轨道线性组合成新的原子轨道, 称为原子轨道的杂化 杂化时,轨道的数目不变 轨道在空间的分布方向和分布情况发生了改变, 沿一个方向更集中地分布,成键能力增强 均和其他原子形成σ键或安排孤对电子, 而不会以空的杂化轨道形式存在。 等性杂化轨道a和b间的角度 I+ncos 0a=0 sp"杂化轨道的系数
在周围原子作用下,根据原子的成键要求,将一 个原子中原有的原子轨道线性组合成新的原子轨道, 称为原子轨道的杂化 杂化时,轨道的数目不变 轨道在空间的分布方向和分布情况发生了改变, 沿一个方向更集中地分布,成键能力增强 均和其他原子形成σ键或安排孤对电子, 而不会以空的杂化轨道形式存在。 spn杂化轨道的系数 5.2 杂化轨道理论 等性杂化轨道a和b间的角度
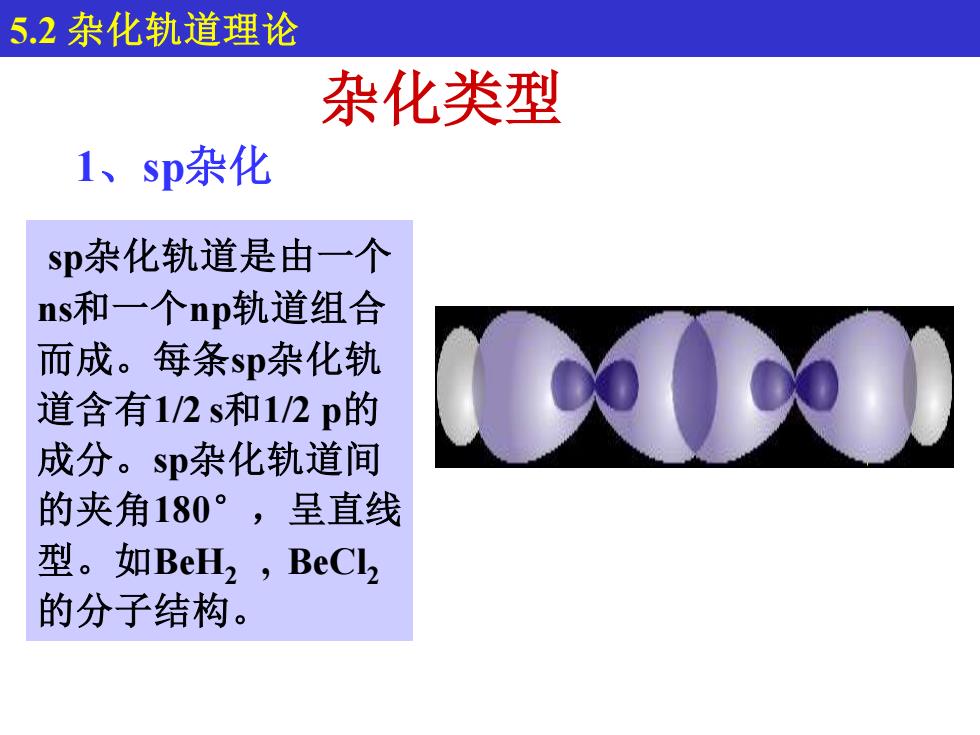
5.2杂化轨道理论 杂化类型 1、sp杂化 sp杂化轨道是由一个 ns和一个np轨道组合 而成。每条sp杂化轨 道含有1/2s和1/2p的 成分。sp杂化轨道间 的夹角180°,呈直线 型。如BeH2,BeCl2 的分子结构
sp杂化轨道是由一个 ns和一个np轨道组合 而成。每条sp杂化轨 道含有1/2 s和1/2 p的 成分。sp杂化轨道间 的夹角180°,呈直线 型。如BeH2 , BeCl2 的分子结构。 杂化类型 1、sp杂化 5.2 杂化轨道理论

5.2杂化轨道理论 sp2杂化轨道是 2、sp2杂化 由一个ns和两个np 轨道组合而成。 每条sp2杂化轨 道含有1/3s和23p 的成分。 sp2杂化轨道间 的夹角为120°, 呈平面三角形。 如BF3分子结构
sp2杂化轨道是 由一个ns和两个np 轨道组合而成。 每条sp2杂化轨 道含有1/3s和2/3p 的成分。 sp2杂化轨道间 的夹角为120° , 呈平面三角形。 如BF3分子结构。 5.2 杂化轨道理论 2、sp2杂化

5.2杂化轨道理论 3、sp3杂化 sp3杂化轨道是由 个ns轨道和三个 np轨道组合而成。 每条sp杂化轨道 含有1/4s和3/4p的成 分。 sp杂化轨道间的 夹角为109°28′, 呈四面体构型, 例如CH结构
sp3杂化轨道是由 一个ns轨道和三个 np轨道组合而成。 每条sp3杂化轨道 含有1/4s和3/4p的成 分。 sp3杂化轨道间的 夹角为109°28′ , 呈四面体构型, 例如CH4结构。 5.2 杂化轨道理论 3、sp3杂化