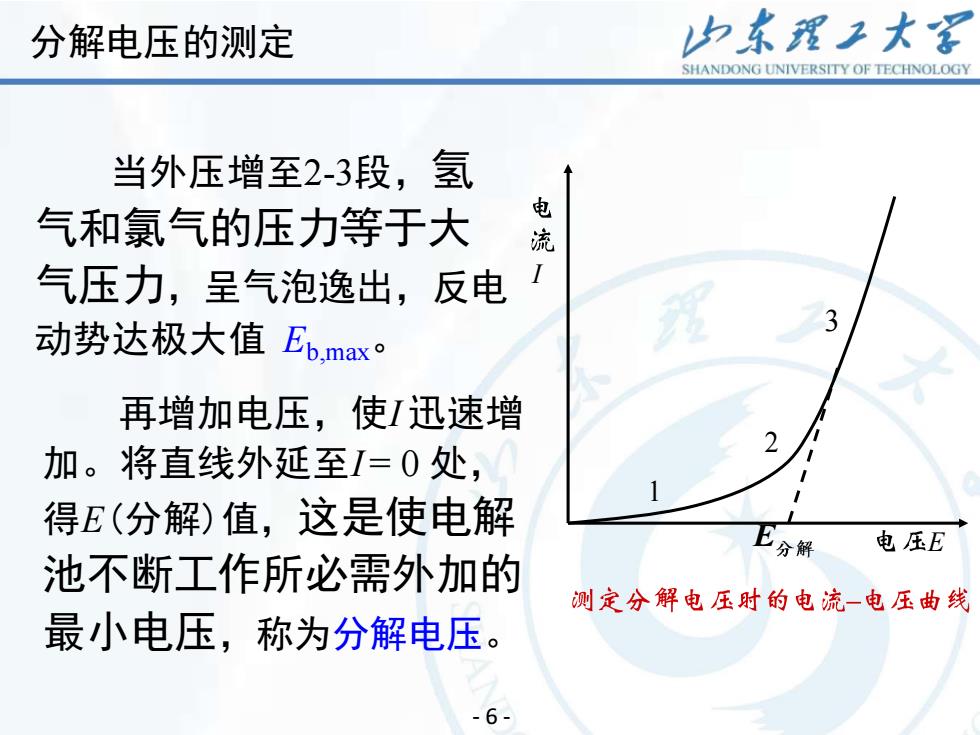
分解电压的测定 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 当外压增至2-3段,氢 气和氯气的压力等于大 电流 气压力,呈气泡逸出,反电 动势达极大值Eb.max 再增加电压,使I迅速增 加。将直线外延至I=0处, 得E(分解)值,这是使电解 电压E 池不断工作所必需外加的 卫分解 测定分解电压时的电流-电压曲线 最小电压,称为分解电压。 6
当外压增至 2 - 3段, 氢 气和氯气的压力等于大 气压力,呈气泡逸出,反电 动势达极大值 Eb,max 。 再增加电压,使I 迅速增 加。将直线外延至I = 0 处, 得E(分解)值,这是使电解 池不断工作所必需外加的 最小电压,称为分解电压 。 E I E 1 2 3 - 6 - 分解电压的测定

实际分解电压 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势n阴和阳),以及克服电 池电阻所产生的电位降R。这三者的加和就称为实 际分解电压。 E(分解)=E(可逆)+△E(不可逆)+IR △E(不可逆)=阳)+7(阴) 显然分解电压的数值会随着通入电流强度的增加而 增加
E E E IR ( ) ( ) ( ) 分解 可逆 不可逆 = + + 要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 和 ,以及克服电 池电阻所产生的电位降 。这三者的加和就称为实 际分解电压。 ( ) 阴 ( ) 阳 IR 显然分解电压的数值会随着通入电流强度的增加而 增加。 = + E( ) ( ) ( ) 不可逆 阳 阴 - 7 - 实际分解电压

§10.2极化作用 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 极化(polarization) 当电极上无电流通过时,电极处于平衡衡状态, 这时的电极电势分别称为阳极可逆(平衡)电势和阴极 可逆(平衡)电势 p逆(阳),p可迪(阴) 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对可逆平衡电势的偏离称为电极的极化
极化(polarization) 当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极可逆(平衡)电势和阴极 可逆(平衡)电势 可逆(阳),可逆(阴) 在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对可逆平衡电势的偏离称为电极的极化。 - 8 - §10.2 极化作用

§10.2极化作用 归东理子大彩 SHANDONG UNIVERSITY OF TECHNOLOGY 根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析。 9
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。 用搅拌和升温的方法可以减少浓差极化 也可以利用滴汞电极上的浓差极化进行极谱分析。 - 9 - §10.2 极化作用
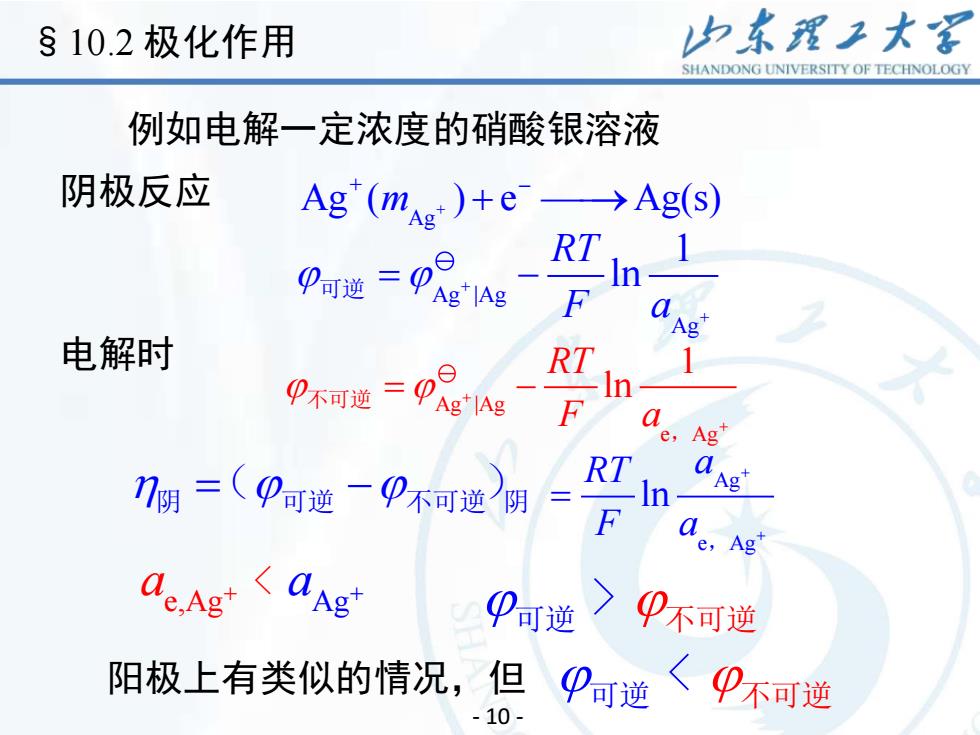
§10.2极化作用 力东理王大 SHANDONG UNIVERSITY OF TECHNOLOGY 例如电解一定浓度的硝酸银溶液 阴极反应 Ag(me)+e→Ag(S) 0a进=p3g F Ag 电解时 a e,Ag RT a 7阴=(可逆一不可逆阴 Ag = e,Ag P可逆〉0不可逆 阳极上有类似的情况,但9可逆〈)不可逆 -10-
例如电解一定浓度的硝酸银溶液 + + Ag Ag ( ) e Ag(s) m − 阴极反应 + ⎯⎯→ + Ag |Ag Ag 1 ln RT F a 可逆 = − + 电解时 Ag |Ag e Ag 1 ln RT F a + + 不可逆 = − , 阴 阴 = − ( ) 可逆 不可逆 Ag e Ag ln RT a F a + + = , e,Ag Ag a + < a + 可逆 > 不可逆 阳极上有类似的情况,但 可逆 < 不可逆 - 10 - §10.2 极化作用