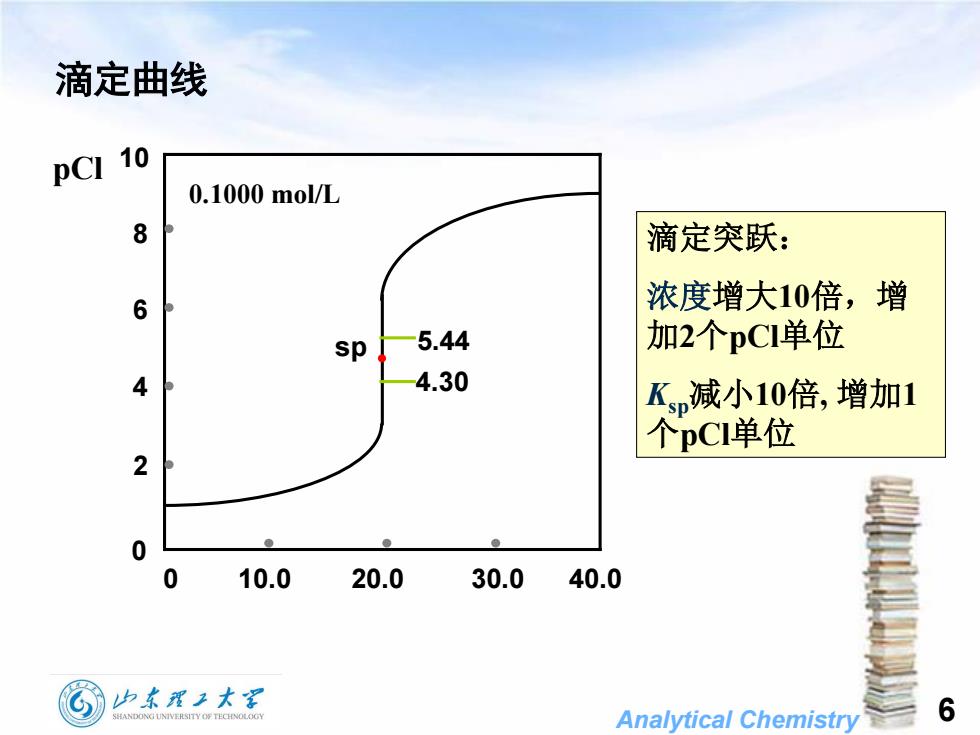
滴定曲线10pCI0.1000 mol/L8滴定突跃:浓度增大10倍,增6加2个pCI单位5.44sp4.304K,减小10倍,增加1个pCI单位20010.020.030.040.0山东理工大学6SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 6 滴定曲线 0 10.0 20.0 30.0 40.0 pCl 0.1000 mol/L 5.44 4.30 0 2 4 6 8 10 sp 滴定突跃: 浓度增大10倍,增 加2个pCl单位 Ksp减小10倍, 增加1 个pCl单位

8.1.2沉淀滴定终点指示剂和沉淀滴定法Ag+ + X-= AgX 银量法(X-为CI、Br、I和SCN-等)莫尔(Mohr)法指示终点方式佛尔哈德(Volhard)法法扬司(Fajans)法山东理工大7SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 7 沉淀滴定终点指示剂和沉淀滴定法 Ag+ + X- = AgX↓ (X-为Cl-、Br-、I -和SCN-等) 银量法 莫尔(Mohr)法 佛尔哈德(Volhard)法 法扬司(Fajans)法 指示终点方式

一、莫尔法1、直接滴定法滴定反应:Ag+ + X-AgX 1滴定剂:AgNO.标准溶液待测物:CI、Br指示剂:K,CrO4(1) 测定原理滴定反应:: Ag++CI=AgCII(白色)Ksp (AgCI) = 1.8 X 10-10终点反应:2Ag++CrO2-=Ag,CrO41(砖红色)Ksp (Ag,CrO4) = 2.0 X 10-12山东翟工大学8SHANDONGUNIVERSITYOFTECHNOLOGYAnalyticalChemistry
Analytical Chemistry 8 滴定反应: Ag+ + Cl- = AgCl↓(白色) Ksp (AgCl) = 1.8×10-10 终点反应: 2Ag+ + CrO4 2-= Ag2CrO4 ↓(砖红色) Ksp (Ag2CrO4 ) = 2.0×10-12 一、莫尔法 指示剂:K2CrO4 滴定反应:Ag+ + X- AgX 滴定剂:AgNO3 标准溶液 待测物:Cl-、Br- (1) 测定原理 1、直接滴定法

(2) 滴定条件1.指示剂的用量化学计量点时:[Ag*],=[CI],=/,(AgCI)=V1.8×10-1°=1.3×10-5形成Ag,CrO4所需的最低的[CrO.2-]:[Ag* },[CrO2 ]sp = K,p(Ag,CrO4)2.0×10-12Ksp(Ag2CrO4)= 1.2 ×10-2则 [CrO]sp=(1.3×105)2[AgP?K,CrO,浓度CrO.2-太大,终点提前理论值1.2 X 10-2 mol·L-1CrO2-太小,终点滞后实验值5.0×10-3 mol·L-1为宜山东理工大字9ANDONGUNIVERSITYOFTECHNOLCAnalytical Chemistry
Analytical Chemistry 9 (2) 滴定条件 - -10 -5 sp [Ag ] [Cl ] (AgCl) 1.8 10 1.3 10 sp sp K [Ag ] [CrO ] (Ag CrO ) sp 2 4 2- 4 2 sp sp K -12 2- -2 sp 2 4 4 sp 2 -5 2 (Ag CrO ) 2.0 10 [CrO ] 1.2 10 [Ag ] (1.3 10 ) K 则 形成Ag2CrO4所需的最低的[CrO4 2- ]: 1. 指示剂的用量 化学计量点时: K2CrO4浓度 理论值 1.2×10-2 mol·L-1 实验值 5.0×10-3 mol·L-1为宜 CrO4 2-太大,终点提前 CrO4 2-太小,终点滞后