
食品技术原理课程讲稿-第十一章 酶技术 第 6 页 ,共 25 页 第二节 酶反应动力学 酶反应动力学是在酶作用过程中来研究酶的学问,包括酶反应速度规律以及 各种因素对酶反应速度的影响。研究酶反应动力学对于了解酶作用机制,确定最 有效的反应系统、反应条件及酶反应器设计都具有重要意义。 一、溶液酶反应动力学 溶液酶反应动力学的基本关系式是酶反应动力学的基础,是我们首先要讨论 的问题。 (一)单底物动力学 单底物反应是由一种底物参与的反应,如:异构酶催化的反应:水解酶催化 反应。后者虽有水参与,但一般条件下水总是过量的。因此可以认为其浓度是恒 定的。 早在 1902 年,V.Heneri 在研究蔗糖酶水解蔗糖的反应中发现随着底物浓 度增加,反应速度上升呈双曲线,如图 23-3 所示。即在低底物浓度时,反应速 度与底物浓度之间 成正比关系,呈现一级反应类型,而在高底物浓度时,反应速度上升很少小呈混 合级反应类型;当底物浓度增加至某种程度时,反应速度达到一个极限值,呈零 级反应。对此现象的解释为酶能同它的底物形成复合物,而这种复合物在分解出 产物的同时,又再生出游离酶。1913 年,L.Michaelis 和 M.L.Menten 发展了前人 的理论,对酶促反应作了大量的定量研究,归纳出一个著名的米氏方程,后经 Briggs 和 Hadlane.的进一步修正,成为酶促反应的基本方程,其反应式及反应 方程如下:
食品技术原理课程讲稿-第十一章 酶技术 第 6 页 ,共 25 页 第二节 酶反应动力学 酶反应动力学是在酶作用过程中来研究酶的学问,包括酶反应速度规律以及 各种因素对酶反应速度的影响。研究酶反应动力学对于了解酶作用机制,确定最 有效的反应系统、反应条件及酶反应器设计都具有重要意义。 一、溶液酶反应动力学 溶液酶反应动力学的基本关系式是酶反应动力学的基础,是我们首先要讨论 的问题。 (一)单底物动力学 单底物反应是由一种底物参与的反应,如:异构酶催化的反应:水解酶催化 反应。后者虽有水参与,但一般条件下水总是过量的。因此可以认为其浓度是恒 定的。 早在 1902 年,V.Heneri 在研究蔗糖酶水解蔗糖的反应中发现随着底物浓 度增加,反应速度上升呈双曲线,如图 23-3 所示。即在低底物浓度时,反应速 度与底物浓度之间 成正比关系,呈现一级反应类型,而在高底物浓度时,反应速度上升很少小呈混 合级反应类型;当底物浓度增加至某种程度时,反应速度达到一个极限值,呈零 级反应。对此现象的解释为酶能同它的底物形成复合物,而这种复合物在分解出 产物的同时,又再生出游离酶。1913 年,L.Michaelis 和 M.L.Menten 发展了前人 的理论,对酶促反应作了大量的定量研究,归纳出一个著名的米氏方程,后经 Briggs 和 Hadlane.的进一步修正,成为酶促反应的基本方程,其反应式及反应 方程如下:
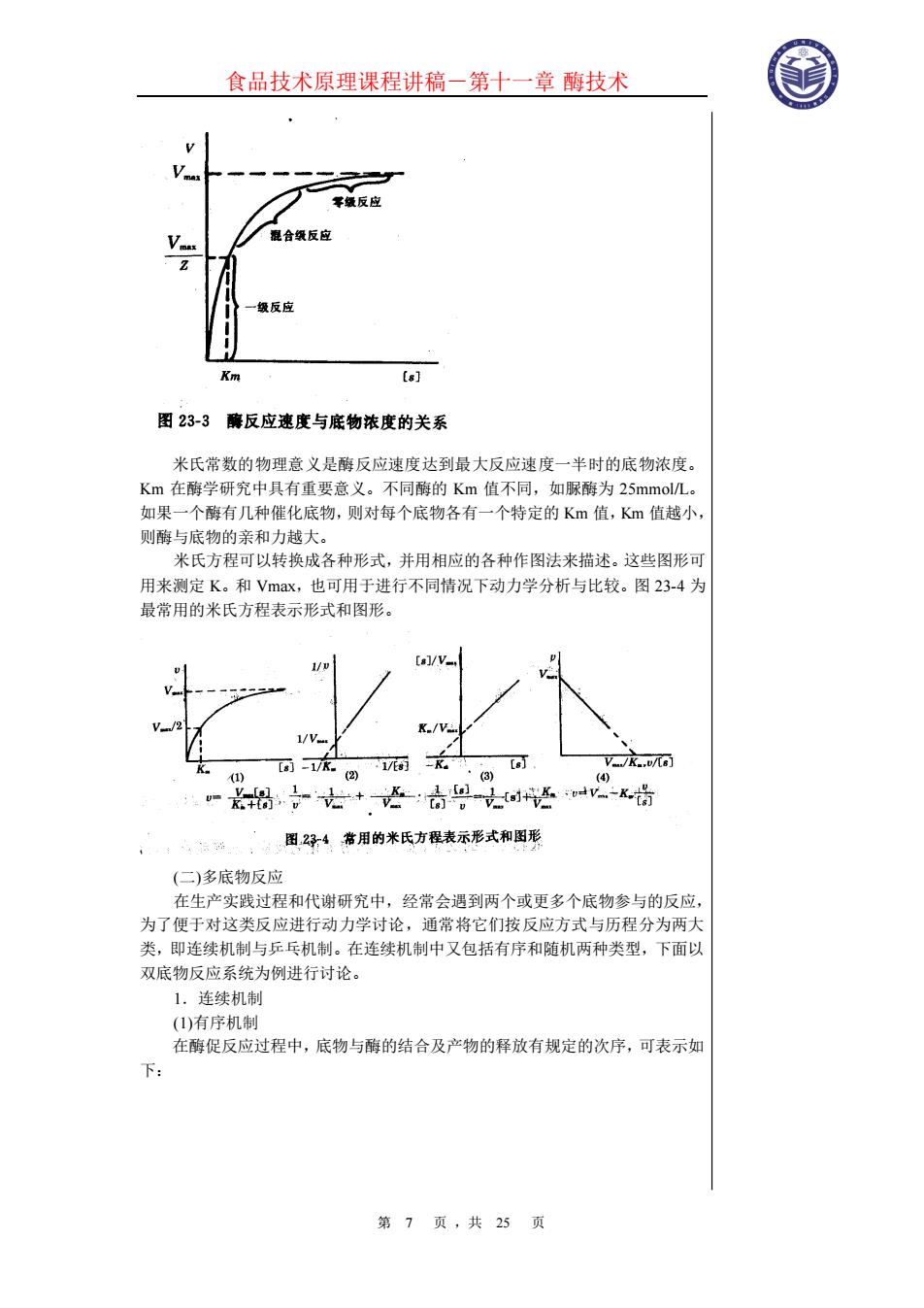
食品技术原理课程讲稿-第十一章 酶技术 第 7 页 ,共 25 页 米氏常数的物理意义是酶反应速度达到最大反应速度一半时的底物浓度。 Km 在酶学研究中具有重要意义。不同酶的 Km 值不同,如脲酶为 25mmol/L。 如果一个酶有几种催化底物,则对每个底物各有一个特定的 Km 值,Km 值越小, 则酶与底物的亲和力越大。 米氏方程可以转换成各种形式,并用相应的各种作图法来描述。这些图形可 用来测定 K。和 Vmax,也可用于进行不同情况下动力学分析与比较。图 23-4 为 最常用的米氏方程表示形式和图形。 (二)多底物反应 在生产实践过程和代谢研究中,经常会遇到两个或更多个底物参与的反应, 为了便于对这类反应进行动力学讨论,通常将它们按反应方式与历程分为两大 类,即连续机制与乒乓机制。在连续机制中又包括有序和随机两种类型,下面以 双底物反应系统为例进行讨论。 1.连续机制 (1)有序机制 在酶促反应过程中,底物与酶的结合及产物的释放有规定的次序,可表示如 下:
食品技术原理课程讲稿-第十一章 酶技术 第 7 页 ,共 25 页 米氏常数的物理意义是酶反应速度达到最大反应速度一半时的底物浓度。 Km 在酶学研究中具有重要意义。不同酶的 Km 值不同,如脲酶为 25mmol/L。 如果一个酶有几种催化底物,则对每个底物各有一个特定的 Km 值,Km 值越小, 则酶与底物的亲和力越大。 米氏方程可以转换成各种形式,并用相应的各种作图法来描述。这些图形可 用来测定 K。和 Vmax,也可用于进行不同情况下动力学分析与比较。图 23-4 为 最常用的米氏方程表示形式和图形。 (二)多底物反应 在生产实践过程和代谢研究中,经常会遇到两个或更多个底物参与的反应, 为了便于对这类反应进行动力学讨论,通常将它们按反应方式与历程分为两大 类,即连续机制与乒乓机制。在连续机制中又包括有序和随机两种类型,下面以 双底物反应系统为例进行讨论。 1.连续机制 (1)有序机制 在酶促反应过程中,底物与酶的结合及产物的释放有规定的次序,可表示如 下:
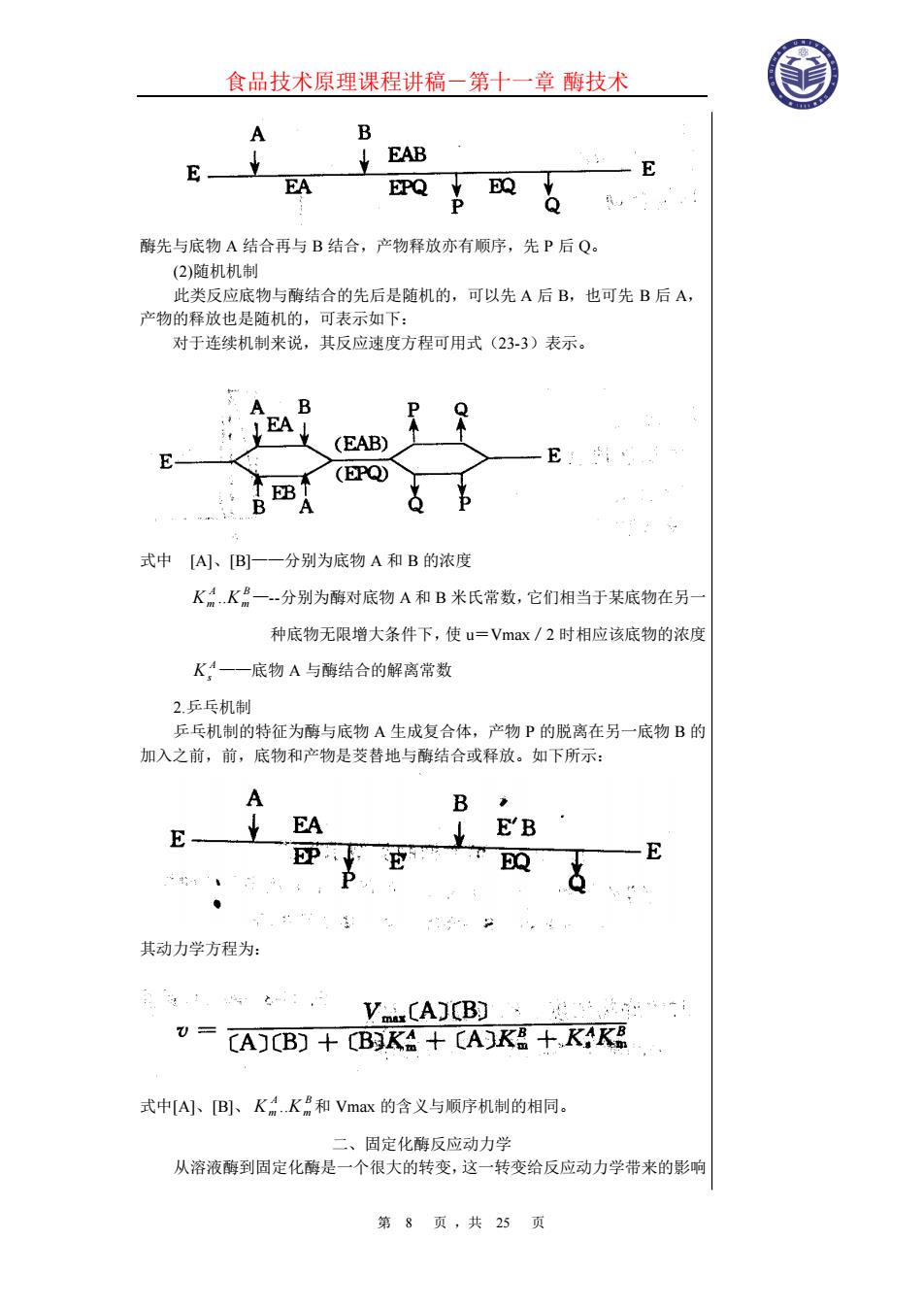
食品技术原理课程讲稿-第十一章 酶技术 第 8 页 ,共 25 页 酶先与底物 A 结合再与 B 结合,产物释放亦有顺序,先 P 后 Q。 (2)随机机制 此类反应底物与酶结合的先后是随机的,可以先 A 后 B,也可先 B 后 A, 产物的释放也是随机的,可表示如下: 对于连续机制来说,其反应速度方程可用式(23-3)表示。 式中 [A]、[B]——分别为底物 A 和 B 的浓度 B m A K m .K —-分别为酶对底物 A 和 B 米氏常数,它们相当于某底物在另一 种底物无限增大条件下,使 u=Vmax/2 时相应该底物的浓度 A Ks ——底物 A 与酶结合的解离常数 2.乒乓机制 乒乓机制的特征为酶与底物 A 生成复合体,产物 P 的脱离在另一底物 B 的 加入之前,前,底物和产物是茭替地与酶结合或释放。如下所示: 其动力学方程为: 式中[A]、[B]、 B m A K m .K 和 Vmax 的含义与顺序机制的相同。 二、固定化酶反应动力学 从溶液酶到固定化酶是一个很大的转变,这一转变给反应动力学带来的影响
食品技术原理课程讲稿-第十一章 酶技术 第 8 页 ,共 25 页 酶先与底物 A 结合再与 B 结合,产物释放亦有顺序,先 P 后 Q。 (2)随机机制 此类反应底物与酶结合的先后是随机的,可以先 A 后 B,也可先 B 后 A, 产物的释放也是随机的,可表示如下: 对于连续机制来说,其反应速度方程可用式(23-3)表示。 式中 [A]、[B]——分别为底物 A 和 B 的浓度 B m A K m .K —-分别为酶对底物 A 和 B 米氏常数,它们相当于某底物在另一 种底物无限增大条件下,使 u=Vmax/2 时相应该底物的浓度 A Ks ——底物 A 与酶结合的解离常数 2.乒乓机制 乒乓机制的特征为酶与底物 A 生成复合体,产物 P 的脱离在另一底物 B 的 加入之前,前,底物和产物是茭替地与酶结合或释放。如下所示: 其动力学方程为: 式中[A]、[B]、 B m A K m .K 和 Vmax 的含义与顺序机制的相同。 二、固定化酶反应动力学 从溶液酶到固定化酶是一个很大的转变,这一转变给反应动力学带来的影响

食品技术原理课程讲稿-第十一章 酶技术 第 9 页 ,共 25 页 是复杂的。这里仅就固定化对酶反应动力学性态(或参数)和实际反应速度的影响 做一粗浅的讨论。 (一)固定化对酶反应动力学参数的影响 1.构象改变 构象改变是指酶在固定化过程中发生了某种扭曲,影响了酶分子的空间结 构,从而导致了酶与底物结合能力或酶催化底物转化能力的改变,见图 23—8(b)。 .2.屏蔽效应 酶经固定化后,由于载体的存在,干扰与影响了酶与底物或其它效应物的结 合,见图 23-8(c) 3.微扰效应 由于载体的疏水、亲水及电荷性质,使得紧邻固定化酶的环境区域通常称为 微环境发生变化而与宏观反应体系不同(见图 23-9),从而使酶的催化能力及酶对 效应物作出调节反应的能力发生改变。 4.分配效应 由于底物和其它各种效应物(包括 H+与 OH- )在微环境与宏观体系间的不等 分布,使得酶反应速度发生变化。 5.扩散效应 扩散效应是指底物·、产物和其它效应物在酶的微环境区与宏观体系之间迁
食品技术原理课程讲稿-第十一章 酶技术 第 9 页 ,共 25 页 是复杂的。这里仅就固定化对酶反应动力学性态(或参数)和实际反应速度的影响 做一粗浅的讨论。 (一)固定化对酶反应动力学参数的影响 1.构象改变 构象改变是指酶在固定化过程中发生了某种扭曲,影响了酶分子的空间结 构,从而导致了酶与底物结合能力或酶催化底物转化能力的改变,见图 23—8(b)。 .2.屏蔽效应 酶经固定化后,由于载体的存在,干扰与影响了酶与底物或其它效应物的结 合,见图 23-8(c) 3.微扰效应 由于载体的疏水、亲水及电荷性质,使得紧邻固定化酶的环境区域通常称为 微环境发生变化而与宏观反应体系不同(见图 23-9),从而使酶的催化能力及酶对 效应物作出调节反应的能力发生改变。 4.分配效应 由于底物和其它各种效应物(包括 H+与 OH- )在微环境与宏观体系间的不等 分布,使得酶反应速度发生变化。 5.扩散效应 扩散效应是指底物·、产物和其它效应物在酶的微环境区与宏观体系之间迁