
例:Pb(s)PbCl2(s)NaCl(aq)AgCl(s),Ag(s) 300K,P:E=0.49004Y(82=-1.8×10pk1 ,=8x10pa,计算300K时,电池反 应的E,△Sm°,△Hm°,△Vm°,△Um° 和△Gm° 解:(-)Pb(s)+2C一→PbCl2(s)+2e (+)2AgCI(s)+2e->2Ag(s)+2CI 总:Pb(S)+2AgCI(s)一→PbCl2(S)+2Ag(s) 6
6 解:(-)Pb(s) + 2Cl- —→ PbCl2 (s) + 2e (+)2AgCl(s) + 2e —→ 2Ag(s) + 2Cl- 总:Pb(s)+2AgCl(s)—→PbCl2 (s) +2Ag(s)

a)Nernst方程: 2 E=E0、R7 Ln 2F 2 apba AgCi 纯固体a=1,E=E°=0.49004V b)△Gm=-nFE=-94.58KJ ∂E ca,S。=nF(87p=-34.7J1K d)A,H=-nFE+nFT()=-105.0KJ
7 2 2 0 2 2 Pb AgCl PbCl Ag a a a a Ln F RT E = E − a)Nernst 方程: 纯固体 aB =1,E=Eo =0.49004V J K T E c r Sm nF P ) ( ) = −34.7 / = KJ T E d) r Hm nFE nFT( ) P = −105.0 = − + b)ΔrGm o = - nFEo =-94.58KJ
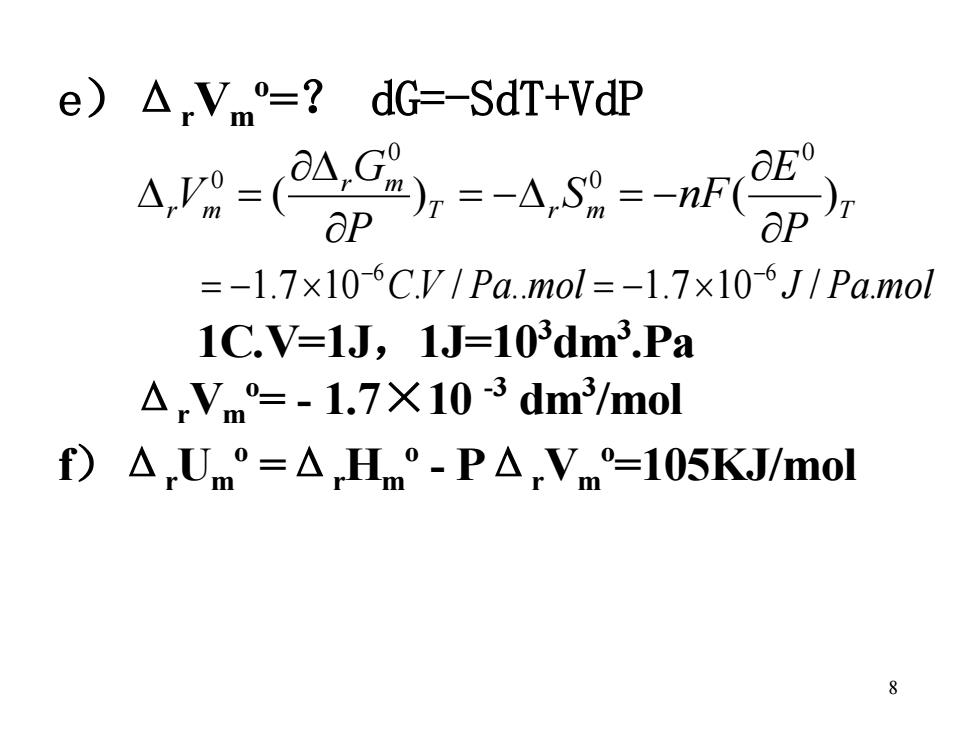
e)AVm=?dG=-SdT+VdP 4-(28=4g=n ap ap =-1.7x10-6C.V/Pa.mol=-1.7×106J/Pa.mol 1C.V=1J,1J=103dm3.Pa A,Vm=-1.7X10-3 dm3/mol f)△,Um°=△Hm°-P△,Vm=105KJ/mol 8
8 e)Δ rVm o =? dG=-SdT+VdP T r m T r m r m P E S nF P G V ( ) ( ) 0 0 0 0 = − = − = 1.7 10 C.V / Pa.mol 1.7 10 J / Pa.mol −6 −6 = − = − 1C.V=1J,1J=103 dm3 .Pa Δ rVm o = - 1.7×10 -3 dm3 /mol f)ΔrUm o =Δ rHm o - PΔ rVm o =105KJ/mol

§8-4电极电势和标准电极电势 一、电极电势 1.例Daniell电池 OZn|ZnSO(m)CuSO(m)Cu Φ1 Φ2 Φ3 电池的电动势E为正负极间电位差,各界 面都有电位差 E=Φ+Φ2+Φ3 Φ1:Zn与ZnSO4溶液界面的电位差 中1=φza/2ns04F-中204/2n中3=中cS04/0y
9 §8-4 电极电势和标准电极电势 一、电极电势 1. 例 Daniell 电池 (-)Zn|ZnSO4 (m1 )‖CuSO4 (m2 )|Cu(+) φ1 φ2 φ3 电池的电动势 E 为正负极间电位差,各界 面都有电位差 E=φ1 +φ2 +φ3 φ1:Zn 与 ZnSO4溶液界面的电位差 φ1 =φZn/ZnSO4= -φZnSO4/Zn φ3 =φCuSO4/Cu

Φ2=Φ扩散<0.03V 用盐桥使其减小 E只取决于E=中1和Φ2 E=Φcus04/0u ΦZns04/Zn 2.电极电势 电池反应是由电极反应构成 (-):Zn一→Zn2++2e氧化, ZnZn2+Φ (+):Cu2++2e-→Cu 还原,Cu2+Cu,Φ+ 总:Zn+Cu+一→Zn2++Cu电动势E Φ=Φzw22+=-z2+/zm半电池Zn2+Zn 10
10 φ2 =φ扩散 <0.03V 用盐桥使其减小 E 只取决于 E=φ1和φ2 E =φCuSO4/Cu - φZnSO4/Zn 2. 电极电势 电池反应是由电极反应构成 (-):Zn —→ Zn2+ + 2e 氧化,Zn|Zn2+ φ- (+):Cu2+ + 2e —→ Cu 还原,Cu2+|Cu,φ+ 总:Zn + Cu2+ —→Zn2+ + Cu 电动势 E φ- =φZn/Zn2+ = -φZn2+/Zn 半电池 Zn2+|Zn