
四、电极电势和电池电动势的计算 1.小结:a)电池表示(原电池) 负极在左边,发生氧化反应(阳极) 正极在右边,发生还原反应(阴极) b) 电极电势一律采用还原电极电势 c)E=Φ+-中=Φ右中左 d)若计算E为正值,表示书写的电池反 应可自发进行 若为负值,表示不能自发进行,且正 负极与书写的正好相反
1 四、电极电势和电池电动势的计算 1. 小结:a)电池表示(原电池) 负极在左边,发生氧化反应(阳极) 正极在右边,发生还原反应(阴极) b)电极电势一律采用还原电极电势 c)E=φ+ -φ- =φ右-φ左 d)若计算 E 为正值,表示书写的电池反 应可自发进行 若为负值,表示不能自发进行,且正 负极与书写的正好相反

2.例:求电池25℃时的电极电势和电动 势,电池反应的△Gm ()CulCu2*(ac2)H(a)H2 (P),Pt(+) ao2+=0.1,au+-0.01,P=91.193Kpa 已知:Φ°ceo=0.337V 解:a)写出电极反应和电池反应 (-))Cu一→Cu2++2e (+)2Ht+2e一→H2 总:Cu+2H时一→Cu2++H2 b)中°中- Pa/P 2F -=-0.117V
2 2. 例:求电池 25℃时的电极电势和电动 势,电池反应的ΔrGm (-)Cu|Cu2 +(aCu2+)‖H + (aH+)|H2 (P1 ),Pt (+) aCu2+ =0.1, aH +=0.01, P1 =91.193Kpa 已知:φ0 Cu2+/Cu =0.337V 解:a)写出电极反应和电池反应 (-) Cu —→ Cu2+ +2e (+) 2H+ + 2e —→ H2 总:Cu + 2H+ —→Cu2+ + H2

ea=°ea-票n-0.3075V Φ a Cu2+ c)电动势E=φ+-Φ=-0.424V E<0,电池反应不能自发进行,书写应为 (-)Pt,H2(P)lH(au4=0.01)lCu2+(ao2+-0.1)Cu(+) d)AG=-nFE-81.832KJ/mol △G>0,不能自发进行 3
3 c) 电动势 E =φ+ -φ- = - 0.424V E < 0,电池反应不能自发进行,书写应为 (-)Pt, H2 (P1 )|H + (aH+=0.01)‖Cu2 +(aCu2+=0.1)| Cu (+) d)ΔGm = -nFE=81.832KJ/mol ΔGm > 0,不能自发进行

五、电极电势产生的原因 1.金属一溶液间的电势一一绝对电极电势 金属Zn棒放入ZnSO4溶液中,表面Zn 分子受溶剂的作用,使其化学键减弱,甚 至有部分Zn原子失去电子变成Zn+进入 溶液,这时电极表面有多余的负电荷而溶 液中有多余的正电荷 a)由于相反电荷的互相吸引,使电极的 b) 负电荷分布在电极的表面上,溶液中 的多余正离子也都被吸引到电极附 近,这个过程对金属的进一步溶解有 阻碍作用
4 五、电极电势产生的原因 1. 金属―溶液间的电势――绝对电极电势 金属 Zn 棒放入 ZnSO4 溶液中,表面 Zn 分子受溶剂的作用,使其化学键减弱,甚 至有部分 Zn 原子失去电子变成 Zn++进入 溶液,这时电极表面有多余的负电荷而溶 液中有多余的正电荷 a) 由于相反电荷的互相吸引,使电极的 b) 负电荷分布在电极的表面上,溶液中 的多余正离子也都被吸引到电极附 近,这个过程对金属的进一步溶解有 阻碍作用
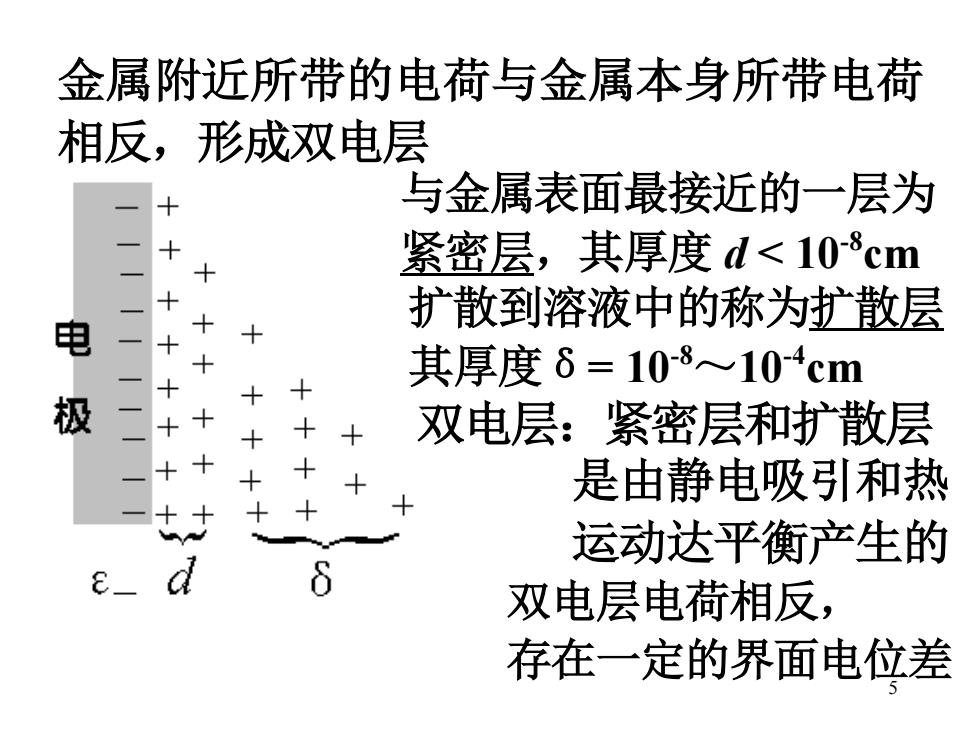
金属附近所带的电荷与金属本身所带电荷 相反,形成双电层 与金属表面最接近的一层为 紧密层,其厚度d<108cm 电 - 扩散到溶液中的称为扩散层 其厚度δ=10-8104cm 极 双电层:紧密层和扩散层 是由静电吸引和热 运动达平衡产生的 e_ d 6 双电层电荷相反, 存在一定的界面电位差
5 金属附近所带的电荷与金属本身所带电荷 相反,形成双电层 与金属表面最接近的一层为 紧密层,其厚度 d < 10-8cm 扩散到溶液中的称为扩散层 其厚度δ= 10-8~10-4cm 双电层:紧密层和扩散层 是由静电吸引和热 运动达平衡产生的 双电层电荷相反, 存在一定的界面电位差