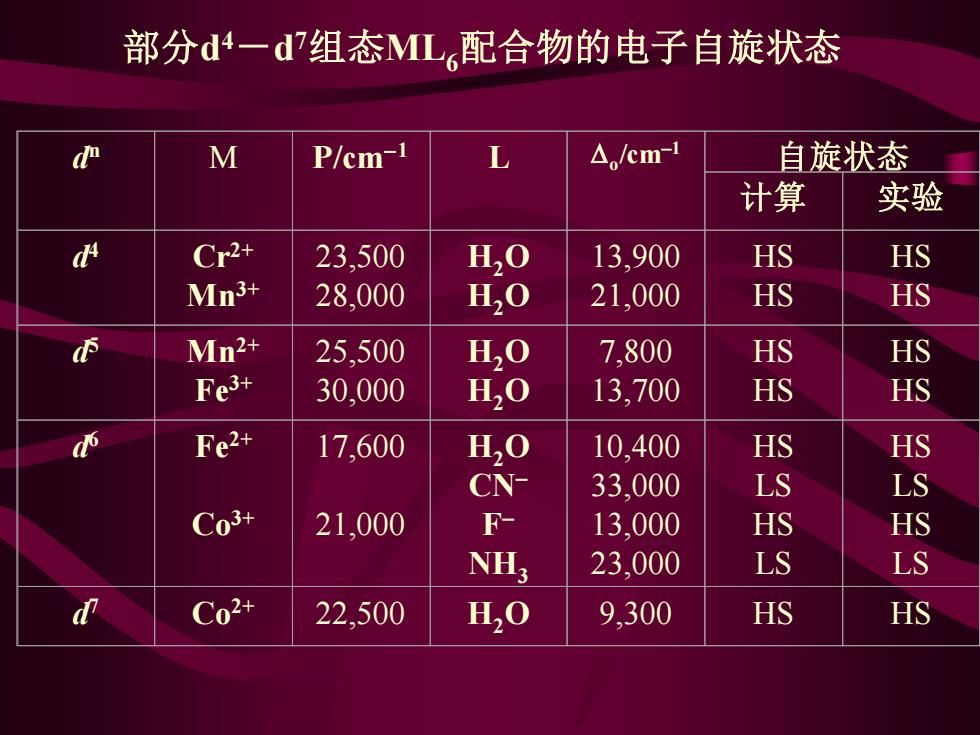
部分d4一d7组态ML配合物的电子自旋状态 % M P/cm-1 △,/cm-1 自旋状态 计算 实验 Cr2+ 23,500 H20 13,900 HS HS Mn3+ 28,000 H,O 21,000 HS HS Mn2+ 25,500 H,O 7,800 HS HS Fe3+ 30,000 H,O 13,700 HS HS Fe2+ 17,600 H,O 10,400 HS HS CN- 33,000 LS LS C03+ 21,000 F- 13,000 HS HS NH; 23,000 LS LS C02+ 22,500 H,O 9,300 HS HS
部分d 4-d 7组态ML6配合物的电子自旋状态 d n M P/cm−1 L o /cm−1 自旋状态 计算 实验 d 4 Cr2+ Mn3+ 23,500 28,000 H2O H2O 13,900 21,000 HS HS HS HS d 5 Mn2+ Fe3+ 25,500 30,000 H2O H2O 7,800 13,700 HS HS HS HS d 6 Fe2+ Co3+ 17,600 21,000 H2O CN− F − NH3 10,400 33,000 13,000 23,000 HS LS HS LS HS LS HS LS d 7 Co2+ 22,500 H2O 9,300 HS HS

二.△大小的表征一电子光谱(或电子光谱,紫 外可见光谱 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 0 excitation Cu(NH3)2+ 强场 紫色 黄色 Cu(OH2)42+ 弱场 蓝色 橙色 大小 Cr(NH3)3+ 强场 橙色 蓝色 大 Cr(OH2)63+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 △的能级范围在紫外可见区域,∴.d区元素的配合物有色
二. O大小的表征―电子光谱(或电子光谱,紫 外可见光谱) 1.单电子的近似的配合物光谱 定性判断: ligand 显色 吸收颜色 O excitation Cu(NH3 )4 2+ 强场 紫色 黄色 大 Cu(OH2 )4 2+ 弱场 蓝色 橙色 小 Cr(NH3 )6 3+ 强场 橙色 蓝色 大 Cr(OH2 )6 3+ 弱场 紫色 黄色 小 ground 只考虑配位场作用,不考虑d电子之间的相互作用 O的能级范围在紫外可见区域,d区元素的配合物有色
R B 吸收光谱颜色和显示的颜色(补色)
R O Y G B I V 吸收光谱颜色和显示的颜色(补色)
Yellow-green Yellow Green SPECTRAL COLORS Orange-yellow (complement to blue) Green-blue (complement to red) Orange Gray Blue-green Red Blue Red-violet Violet-blue (complement (complement to green) to yellow) Blue-violet
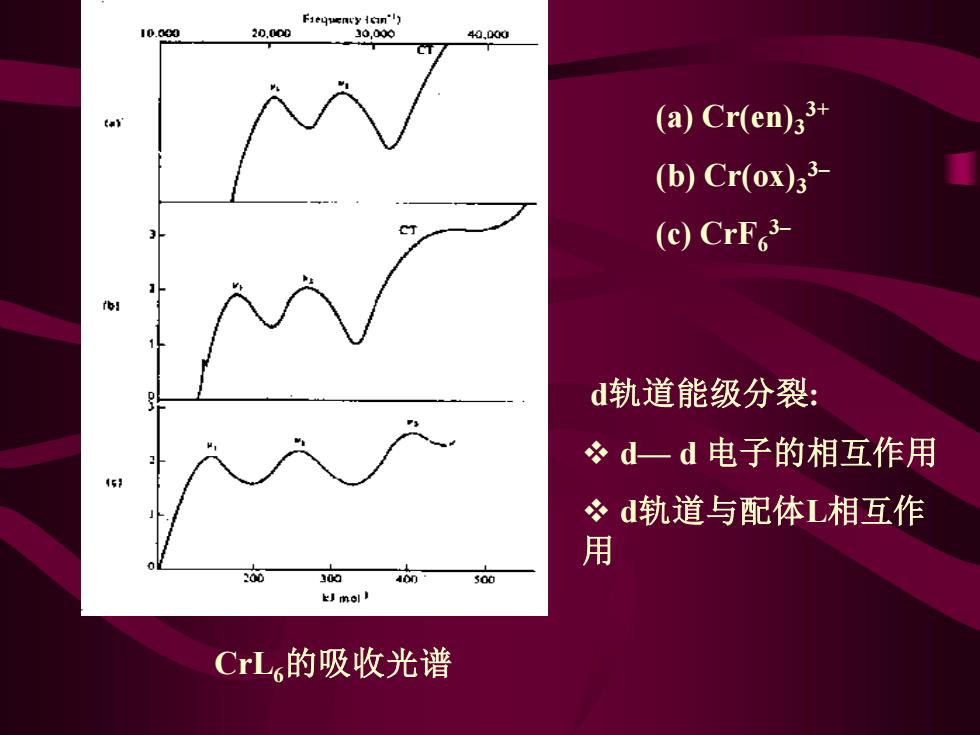
Fiequency icin') 10.040 20.000 10,000 44.000 (a)Cr(en)33+ (b)Cr(ox)33 (c)CrF3 d轨道能级分裂: 必d一d电子的相互作用 51 冬d轨道与配体L相互作 用 200 100 500 kJmol CrL,的吸收光谱
CrL6的吸收光谱 (a) Cr(en)3 3+ (b) Cr(ox)3 3– (c) CrF6 3– d轨道能级分裂: ❖ d— d 电子的相互作用 ❖ d轨道与配体L相互作 用