
●最高氧化态氢氧化物的酸碱性 在化合物R(O中,可以有两种离解方式: R(OH)n→R(OH)m-1+OH 碱式离解 R(OH)n→RO(OH)m1+H酸式离解 R(OH山按碱式还是按酸式离解,主要是看R-O键 和O-H键的相对强弱,若R-O键弱,就进行碱式电 离,若O-H键弱时就进行酸式离解。 R-O与O-H键的相对强弱又决定于“离子势” 阳离子的极化能力。由卡特雷奇(Cart-ledge,G.) 提出的离子势的表示式: 阳离子电荷Z (r-m 阳离子半经 r
⚫最高氧化态氢氧化物的酸碱性 ✓ 在化合物R(OH)n中,可以有两种离解方式: R(OH)n→R(OH)n-1+OH- 碱式离解 R(OH)n→RO(OH)n-1+H+ 酸式离解 ✓ R(OH)n按碱式还是按酸式离解,主要是看R-O键 和O-H键的相对强弱,若R-O键弱,就进行碱式电 离,若O-H键弱时就进行酸式离解。 ✓ R-O与O-H键的相对强弱又决定于“离子势”—— 阳离子的极化能力。由卡特雷奇(Cart-ledge,G.H) 提出的离子势的表示式: (r - nm) r Z = = 阳离子半经 阳离子电荷

VΦ>10,ROH显酸性 Φ判别式 7<√Φ<10,ROH显两性 √Φ<7,ROH显碱性 R(O中R半径小电荷高,对氧原子的吸引力强R-O键能 大,则R(OH)主要是酸式解离,显酸性。反之亦然。如: S6+:Z=+6=0.030nm-200 当2>10时R(OH,显酸性 A3+:Z=+3r=0.051nm-59 当10>2>7时R(OH显两性 Na:Z=1r=0.097nm-10 当2<7时R(OH)显碱性
R(OH)n中R半径小电荷高,对氧原子的吸引力强R-O键能 大,则R(OH)n主要是酸式解离,显酸性。反之亦然。如: S 6+:Z=+6 r=0.030nm =200 当 1/2>10时R(OH)n显酸性 Al3+:Z=+3 r=0.051nm =59 当10> 1/2>7时R(OH)n显两性 Na+ :Z=1 r=0.097nm =10 当 1/2<7时R(OH)n显碱性 显碱性 显两性 显酸性 ROH ROH ROH 7, 7 10, 10, 判别式
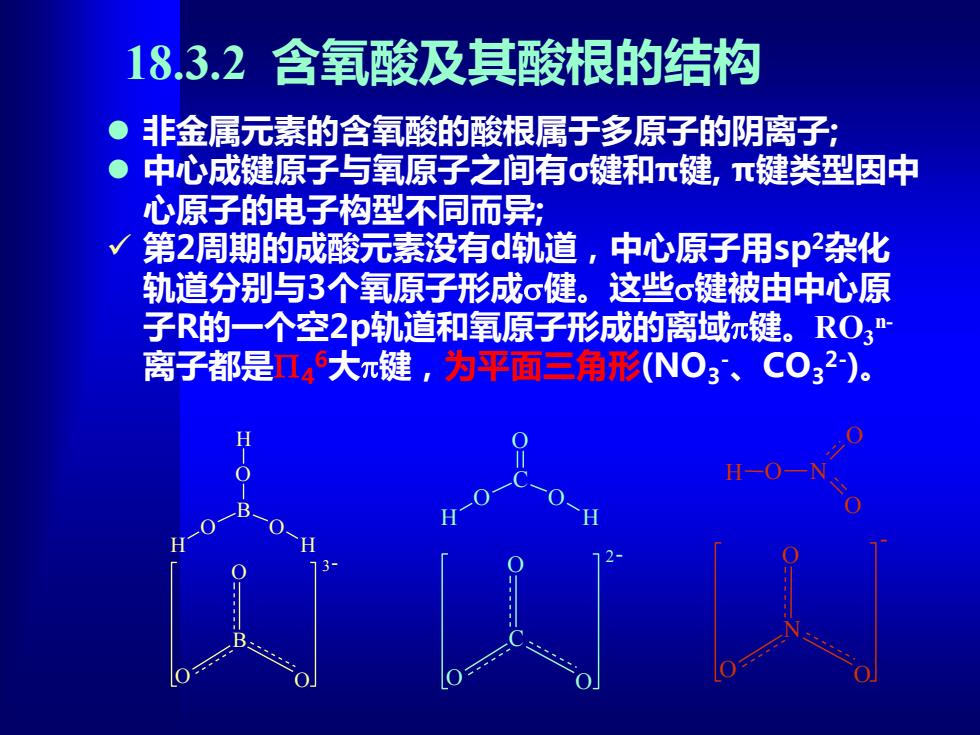
18.3.2含氧酸及其酸根的结构 。非金属元素的含氧酸的酸根属于多原子的阴离子; ● 中心成键原子与氧原子之间有σ键和π键,π键类型因中 心原子的电子构型不同而异; √第2周期的成酸元素没有d轨道,中心原子用sp杂化 轨道分别与3个氧原子形成σ健。这些σ键被由中心原 子R的一个空2p轨道和氧原子形成的离域π键。RO3" 离子都是n4大π键,为平面三角形(N03、C032)。 H-O
18.3.2 含氧酸及其酸根的结构 ⚫ 非金属元素的含氧酸的酸根属于多原子的阴离子; ⚫ 中心成键原子与氧原子之间有σ键和π键, π键类型因中 心原子的电子构型不同而异; ✓ 第2周期的成酸元素没有d轨道,中心原子用sp2杂化 轨道分别与3个氧原子形成健。这些键被由中心原 子R的一个空2p轨道和氧原子形成的离域键。RO3 n- 离子都是4 6大键,为平面三角形(NO3 -、CO3 2- )。 B O O O H H H B O O O 3- C O O O H H C O O O 2- H O N O O N O O O -
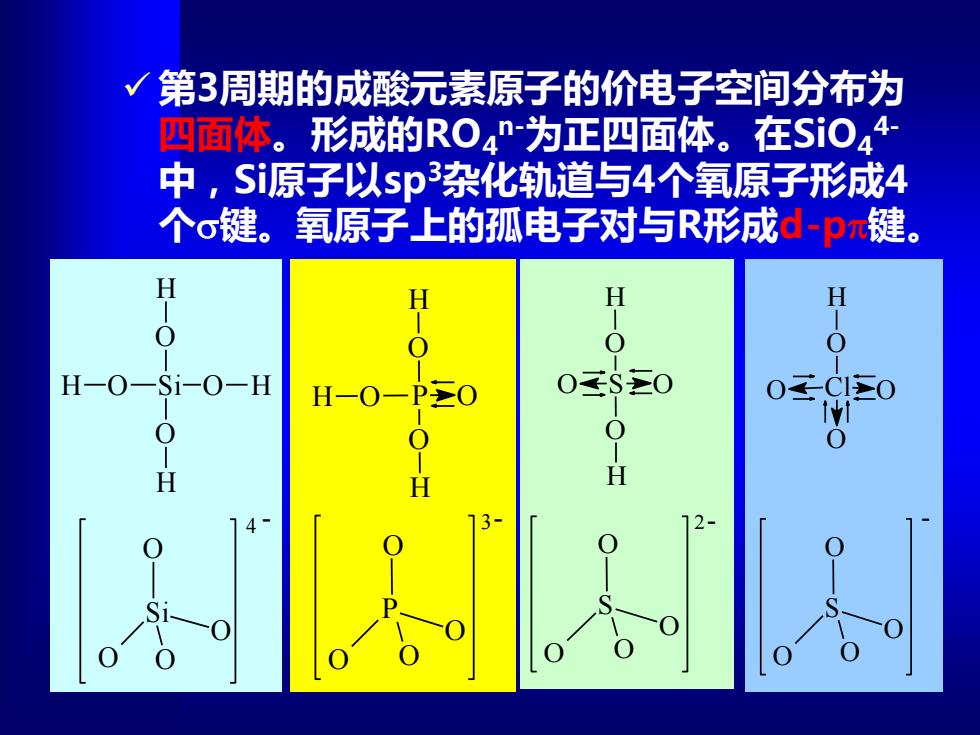
第3周期的成酸元素原子的价电子空间分布为 四面体。形成的RO4n-为正四面体。在SiO44- 中,Si原子以sp杂化轨道与4个氧原子形成4 个o键。氧原子上的孤电子对与R形成d-pπ键。 H H H 0 H-O-Si-0-H H-O一PO 0¥$主0 0 0 H H H
✓ 第3周期的成酸元素原子的价电子空间分布为 四面体。形成的RO4 n-为正四面体。在SiO4 4- 中,Si原子以sp3杂化轨道与4个氧原子形成4 个键。氧原子上的孤电子对与R形成d-p键。 4 - Si O O O O Si O O O O H H H H 3- P O O O O P O O H H H O O S O O H H O O 2- S O O O O Cl O O H O O - S O O O O