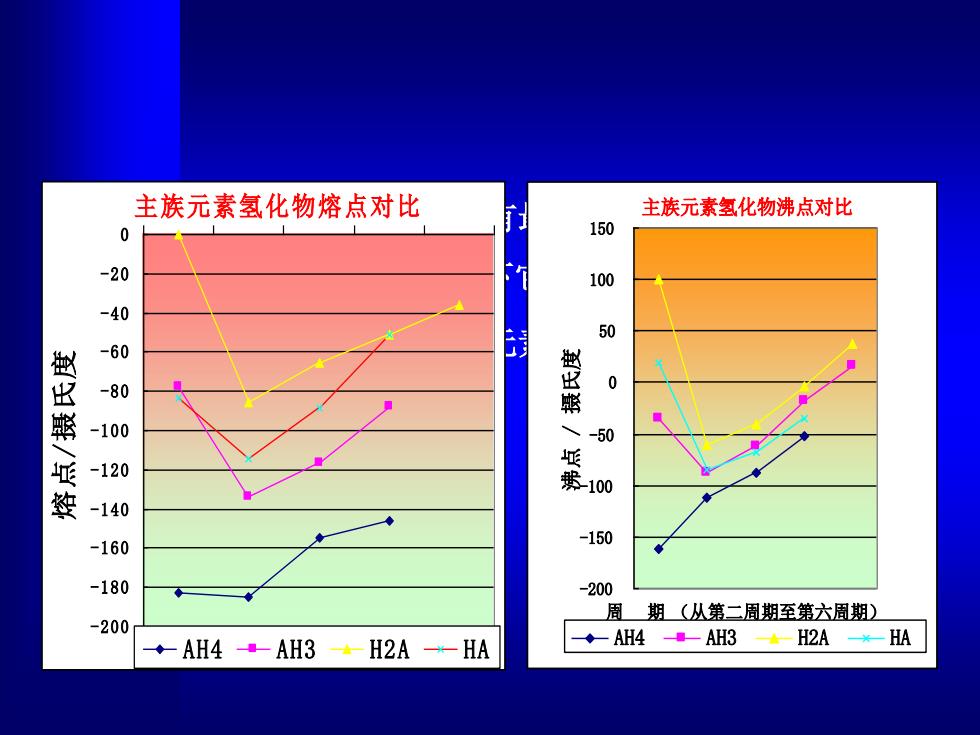
主族元素氢化物熔点对比 主族元素氢化物沸点对比 0 150 -20 100 40 50 60 -80 0 燕 -100 -50 -120 100 姿 -140 -160 -150 -180 -200 周期(丛第二周期至第六周期) -200 ◆AH4-AH3·-H2A-HA ◆AH4-AH3◆-H2A*-HA
⚫ 非金属元素都能形成具有最高氧化态的共价型的简 单氢化物,在通常情况下它们为气体或挥发性液体。 ⚫ 它们的熔点、沸点都按元素在周期表中所处的族和 周期呈周期性的变化。 主族元素氢化物熔点对比 -200 -180 -160 -140 -120 -100 -80 -60 -40 -20 0 熔点/摄氏度 AH4 AH3 H2A H A 主族元素氢化物沸点对比 -200 -150 -100 -50 0 50 100 150 周 期 (从第二周期至第六周期) 沸点 / 摄氏度 AH4 AH3 H2A HA

18.2.1热稳定性 ·分子型氢化物的热稳定性,在同一周期中,从 左到右逐渐增强; ●在同一族中,自上而下逐渐减小; ●变化规律与非金属元素电负性的变化规律是一 致的。在同一族中,分子型氢化物的热稳定性 还与键能自上而下越来越弱有关
18.2.1 热稳定性 ⚫ 分子型氢化物的热稳定性,在同一周期中,从 左到右逐渐增强; ⚫ 在同一族中,自上而下逐渐减小; ⚫ 变化规律与非金属元素电负性的变化规律是一 致的。在同一族中,分子型氢化物的热稳定性 还与键能自上而下越来越弱有关
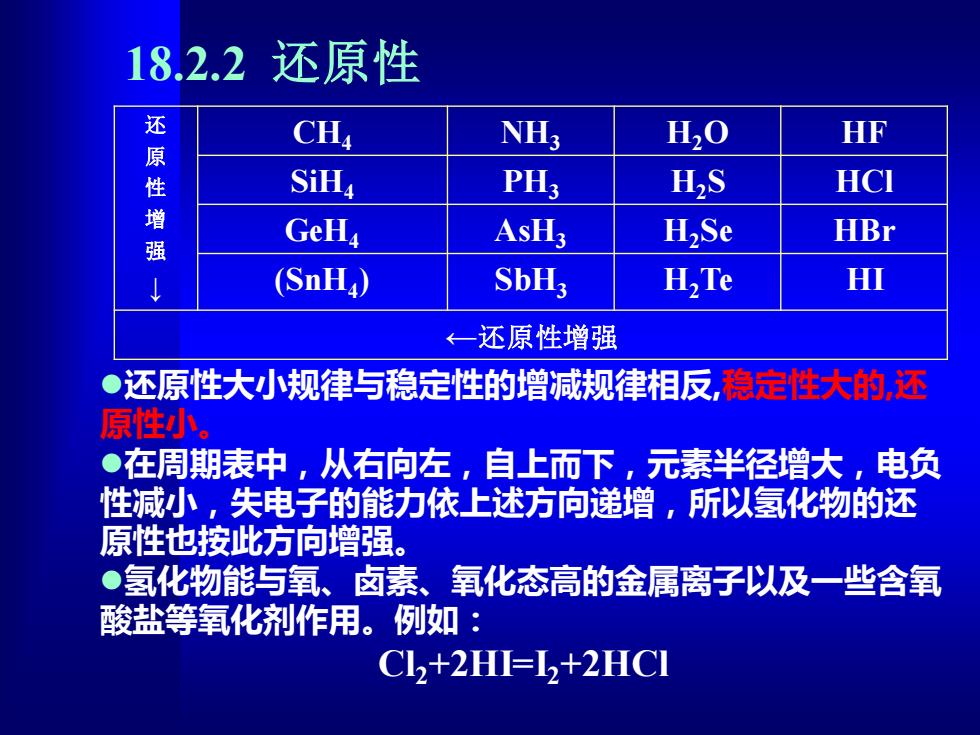
18.2.2还原性 还 CH, NH; H,O HF 性 SiHa PH; H,S HCI 强 GeHa AsH3 HSe HBr (SnH) SbH3 H,Te HI ←一还原性增强 ●还原性大小规律与稳定性的增减规律相反,稳定性大的,还 原性小。 ●在周期表中,从右向左,自上而下,元素半径增大,电负 性减小,失电子的能力依上述方向递增,所以氢化物的还 原性也按此方向增强。 ●氢化物能与氧、卤素、氧化态高的金属离子以及一些含氧 酸盐等氧化剂作用。例如: Cl2+2H=12+2HC1
18.2.2 还原性 还 原 性 增 强 ↓ CH4 NH3 H2O HF SiH4 PH3 H2S HCl GeH4 AsH3 H2Se HBr (SnH4 ) SbH3 H2Te HI ←还原性增强 ⚫还原性大小规律与稳定性的增减规律相反,稳定性大的,还 原性小。 ⚫在周期表中,从右向左,自上而下,元素半径增大,电负 性减小,失电子的能力依上述方向递增,所以氢化物的还 原性也按此方向增强。 ⚫氢化物能与氧、卤素、氧化态高的金属离子以及一些含氧 酸盐等氧化剂作用。例如: Cl2+2HI=I2+2HCl
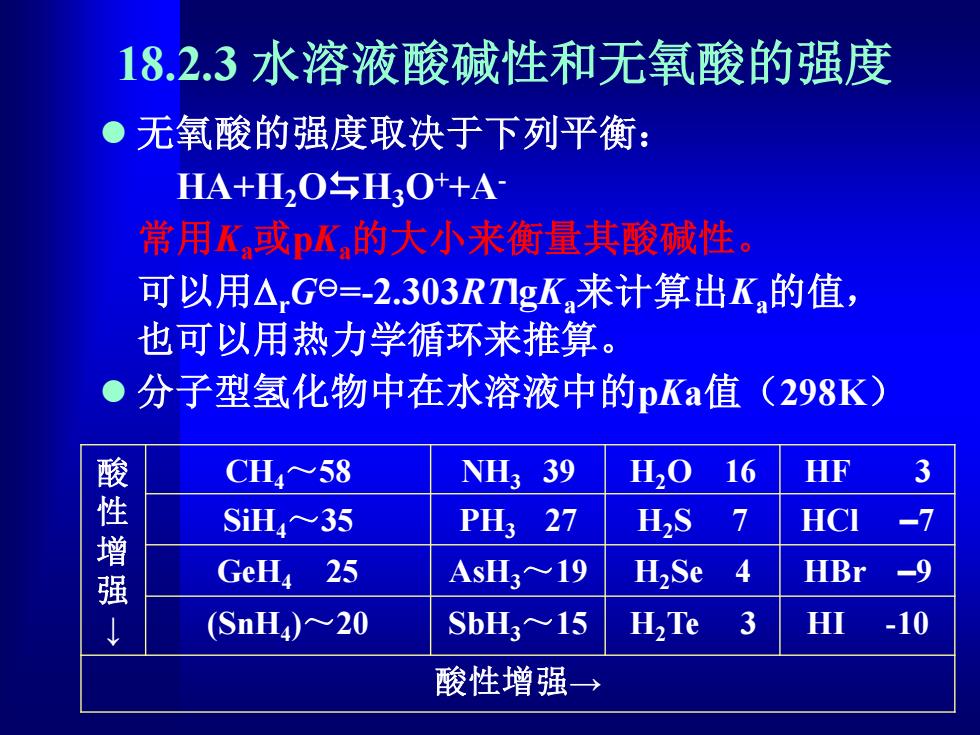
18.2.3水溶液酸碱性和无氧酸的强度 。无氧酸的强度取决于下列平衡: HA+H2OH3O++A 常用K或DK的大小来衡量其酸碱性。 可以用△Ge=-2.303RTgK,来计算出K的值, 也可以用热力学循环来推算。 ●分子型氢化物中在水溶液中的pKa值(298K) CH~58 NH339 H,O 16 HF SiH~35 PHs 27 H>S 7 HCI 增强 GeHa 25 ASH3~19 HSe 4 HBr (SnH)~20 SbH3≈15 H,Te 3 HI -10 酸性增强→
18.2.3 水溶液酸碱性和无氧酸的强度 ⚫ 无氧酸的强度取决于下列平衡: HA+H2OH3O++A- 常用Ka或pKa的大小来衡量其酸碱性。 可以用rG=-2.303RTlgKa来计算出Ka的值, 也可以用热力学循环来推算。 ⚫ 分子型氢化物中在水溶液中的pKa值(298K) 酸 性 增 强 ↓ CH4 ~58 NH3 39 H2O 16 HF 3 SiH4 ~35 PH3 27 H2S 7 HCl –7 GeH4 25 AsH3 ~19 H2Se 4 HBr –9 (SnH4 )~20 SbH3 ~15 H2Te 3 HI -10 酸性增强→

18.3含氧酸 18.3.1最高氧化态氢氧化物的酸碱性 非金属元素氧化物的水合物为含有一个或多个OH基团的氢氧化 物。 第2、3周期非金属元素的氢氧化物 第2周期的元素 第3周期的元素 非金属元素R+n B+3 C4 N+5 Si4 p5 S+6 CI*7 R*/6H 0.15 0.11 0.08 0.30 0.25 0.210.19 配位数 3 2 2 4 4 3 3 是高氧化态的氢氧 B(OH)3 C(OH)4N(OH)5 Si(OH)4P(OH)s S(OH)CI(OH) 化物R(OHDn 脱水后的氢氧化物不脱水H2CO3HNO3 H2SiO3 H3PO4H2SO4 HCIO4 或不脱水
18.3.1最高氧化态氢氧化物的酸碱性 ⚫ 非金属元素氧化物的水合物为含有一个或多个OH基团的氢氧化 物。 ⚫ 这类化合物的中心原子R,它周围能结合多少个OH,取决于R+n的 电荷数及半径大小。 通常R+n的电荷高,半径大时,结合的OH基团数目多。当R+n 的电荷高且半径小时,例如Cl+7应能结合七个OH基团,但是由于 它的半径太小(0.027nm),容纳不了这许多OH,势必脱水,直 到Cl+7周围保留的异电荷离子或基团数目,既能满足Cl+7的氧化 态又能满足它的配位数。 ⚫ 处于同一周期的元素,其配位数大致相同。 非金属元素R 配位数 是高氧化态的氢氧 化 物 脱水后的氢氧化物 第2周期的元素 第3周期的元素 第2、3周期非金属元素的氢氧化物 不脱水 或不脱水 +n r / rO H - R n+ R(OH)n B +3 C +4 N +5 Si +4 P +5 S + 6 Cl +7 0.15 0.11 0.08 0.30 0.25 0.21 0.19 3 2 4 B(OH) 3 C(OH) 4 N(OH) 5 Si(OH) 4 S(OH) 6Cl(OH) P 7 (OH) 5 2 4 3 3 H2CO3 HNO3 H2 SiO3 H3 PO4H2 SO4 HClO4 18.3 含氧酸