
由内质网到高尔基体的蛋白转运中,大多数跨膜蛋白是直接结合在COP川衣被上,但是 少数跨膜蛋白和多数可溶性蛋白通过受体与COP川衣被结合,这些受体在完成转运后,通过 COPI衣被小泡返回内质网。 COP川衣被所识别的分选信号位于跨膜蛋白胞质面的结构域,形式多样,有些包含双酸 性基序D曰X[D(D为Asp,E为Glu,X为任何一种氨基酸),如Asp-X-Glu序列,其他一 些具有短的疏水基序,如FF,YYM,FY,LL,IL等等(其中F为Phe,Y为Tyr,M为 Met,L为Leu,I为lle)。 二、衣被的形成 衣被是在一类叫作衣被召集GTP酶(coat-recruitment GTPase)作用下形成的。衣被召 集GTP酶通常为单体GTP酶(monomeric GTPase),也叫G蛋白,起分子开关的作用, 结合GDP的形式没有活性,位于细胞质中,结合GTP而活化,转位至膜上,能与衣被蛋白 结合,促进核化和组装。 G蛋白具有两类重要的调节蛋白,即:鸟苷酸交换因子(guanine-nucleotide exchange factor,GEF)和GTP酶激活蛋白(GTPase activating protein,.GAP)。GEF的作用是使G 蛋白释放GDP,结合GTP而激活。GAP的作用是激活G蛋白的酶活性,使GTP水解,G蛋 白失活,G蛋白本身的GTP酶活性不高。除单体G蛋白以外,三聚体G蛋白也起分子开关的 作用,控制衣被小泡的形成。 衣被召集GTP酶包括Arf蛋白和Sar1蛋白(图6-9),Arf参与高尔基体上笼形蛋白衣 被与COPI衣被的形成,Sr1参与内质网上COPⅡ衣被的形成,两者的作用方式大体相 似。质膜上笼形蛋白衣被的形成也与GTP酶有关,但其成分尚不明确。 衣被召集GTP酶大量存在于细胞质中,但处于结合GDP的失活状态。当内质网上要形 成COPI衣被小泡时,Sar1释放GDP结合GTP而激活,激活的Sar1暴露出一条脂肪酸的 尾巴,插入内质网膜,然后开始召集衣被蛋白,以衣被蛋白为模型形成运输小泡。活化的衣被 召集GTP酶还可以激活磷脂酶D(phospholipase D),将一些磷脂水解,使形成衣被的蛋白 质牢固地结合在膜上。 衣被召集GTP酶对衣被的形成其动态调节作用,当多数衣被召集GTP酶处于结合GTP 的状态时,它催化衣被的形成:反之当多数衣被召集GTP酶处于结合GDP的状态时,它催 化衣被的解体。因此衣被的形成过程是边形成便解体的动态过程,只有在组装速率大于解体速 率时,才能形成衣被小泡
由内质网到高尔基体的蛋白转运中,大多数跨膜蛋白是直接结合在 COP II 衣被上,但是 少数跨膜蛋白和多数可溶性蛋白通过受体与 COP II 衣被结合,这些受体在完成转运后,通过 COP I 衣被小泡返回内质网。 COP II 衣被所识别的分选信号位于跨膜蛋白胞质面的结构域,形式多样,有些包含双酸 性基序[DE]X[DE](D 为 Asp,E 为 Glu,X 为任何一种氨基酸),如 Asp-X-Glu 序列,其他一 些具有短的疏水基序,如 FF,YYM,FY,LL,IL 等等(其中 F 为 Phe,Y 为 Tyr,M 为 Met,L 为 Leu,I 为 Ile)。 二、衣被的形成 衣被是在一类叫作衣被召集 GTP 酶(coat-recruitment GTPase)作用下形成的。衣被召 集 GTP 酶通常为单体 GTP 酶(monomeric GTPase),也叫 G 蛋白,起分子开关的作用, 结合 GDP 的形式没有活性,位于细胞质中,结合 GTP 而活化,转位至膜上,能与衣被蛋白 结合,促进核化和组装。 G 蛋白具有两类重要的调节蛋白,即:鸟苷酸交换因子(guanine-nucleotide exchange factor, GEF)和 GTP 酶激活蛋白(GTPase activating protein, GAP)。GEF 的作用是使 G 蛋白释放 GDP,结合 GTP 而激活。GAP 的作用是激活 G 蛋白的酶活性,使 GTP 水解,G 蛋 白失活,G 蛋白本身的 GTP 酶活性不高。除单体 G 蛋白以外,三聚体 G 蛋白也起分子开关的 作用,控制衣被小泡的形成。 衣被召集 GTP 酶包括 Arf 蛋白和 Sar 1 蛋白(图 6-9),Arf 参与高尔基体上笼形蛋白衣 被与 COP I 衣被的形成,Sar 1 参与内质网上 COP II 衣被的形成,两者的作用方式大体相 似。质膜上笼形蛋白衣被的形成也与 GTP 酶有关,但其成分尚不明确。 衣被召集 GTP 酶大量存在于细胞质中,但处于结合 GDP 的失活状态。当内质网上要形 成 COPII 衣被小泡时,Sar 1 释放 GDP 结合 GTP 而激活,激活的 Sar 1 暴露出一条脂肪酸的 尾巴,插入内质网膜,然后开始召集衣被蛋白,以衣被蛋白为模型形成运输小泡。活化的衣被 召集 GTP 酶还可以激活磷脂酶 D(phospholipase D),将一些磷脂水解,使形成衣被的蛋白 质牢固地结合在膜上。 衣被召集 GTP 酶对衣被的形成其动态调节作用,当多数衣被召集 GTP 酶处于结合 GTP 的状态时,它催化衣被的形成;反之当多数衣被召集 GTP 酶处于结合 GDP 的状态时,它催 化衣被的解体。因此衣被的形成过程是边形成便解体的动态过程,只有在组装速率大于解体速 率时,才能形成衣被小泡

Sec13p-Sec31p Cytosol Sarlp-GDP Sec24p Sec23p Sec12p Sar1p-GTP Cargo Lumen Proteins 图6-9COPl衣被小泡的组装引自Juan S.Bonifacino等2004 三、膜泡运输的定向机制 衣被小泡沿着细胞内的微管被运输到靶细胞器,马达蛋白水解ATP提供运输的动力。各 类运输小泡之所以能够被准确地和靶膜融合,是因为运输小泡表面的标志蛋白能被靶膜上的受 体识别,其中涉及识别过程的两类关键性的蛋白质是SNAREs(soluble NSF attachment protein receptor)和Rabs(targeting GTPase)。其中SNARE介导运输小泡特异性停泊和 融合,Rab的作用是使运输小泡靠近靶膜。 (-)SNAREs SNAREs的作用是保证识别的特异性和介导运输小泡与目标膜的融合,动物细胞中己发 现20多种SNAREs,分别分布于特定的膜上,位于运输小泡上的叫作V-SNAREs,位于靶膜 上的叫作t-SNAREs(图6-10)。V-SNAREs和t-SNAREs都具有一个螺旋结构域,能相互缠 绕形成跨SNAREs复合体(trans-SNAREs complexes,图6-11),并通过这个结构将运输 小泡的膜与靶膜拉在一起,实现运输小泡特异性停泊和融合。实验证明包含了SNARE的脂质 体和包含匹配SNARE的脂质体间可发生融合,尽管速度较慢。这说明除了SNARE之外,还 有其他的蛋白参与运输泡与目的膜的融合
图 6-9 COP II 衣被小泡的组装 引自 Juan S. Bonifacino 等 2004 三、膜泡运输的定向机制 衣被小泡沿着细胞内的微管被运输到靶细胞器,马达蛋白水解 ATP 提供运输的动力。各 类运输小泡之所以能够被准确地和靶膜融合,是因为运输小泡表面的标志蛋白能被靶膜上的受 体识别,其中涉及识别过程的两类关键性的蛋白质是 SNAREs(soluble NSF attachment protein receptor)和 Rabs(targeting GTPase)。其中 SNARE 介导运输小泡特异性停泊和 融合,Rab 的作用是使运输小泡靠近靶膜。 (一)SNAREs SNAREs 的作用是保证识别的特异性和介导运输小泡与目标膜的融合,动物细胞中已发 现 20 多种 SNAREs,分别分布于特定的膜上,位于运输小泡上的叫作 v-SNAREs,位于靶膜 上的叫作 t-SNAREs(图 6-10)。v-SNAREs 和 t-SNAREs 都具有一个螺旋结构域,能相互缠 绕形成跨 SNAREs 复合体(trans-SNAREs complexes,图 6-11),并通过这个结构将运输 小泡的膜与靶膜拉在一起,实现运输小泡特异性停泊和融合。实验证明包含了 SNARE 的脂质 体和包含匹配 SNARE 的脂质体间可发生融合,尽管速度较慢。这说明除了 SNARE 之外,还 有其他的蛋白参与运输泡与目的膜的融合
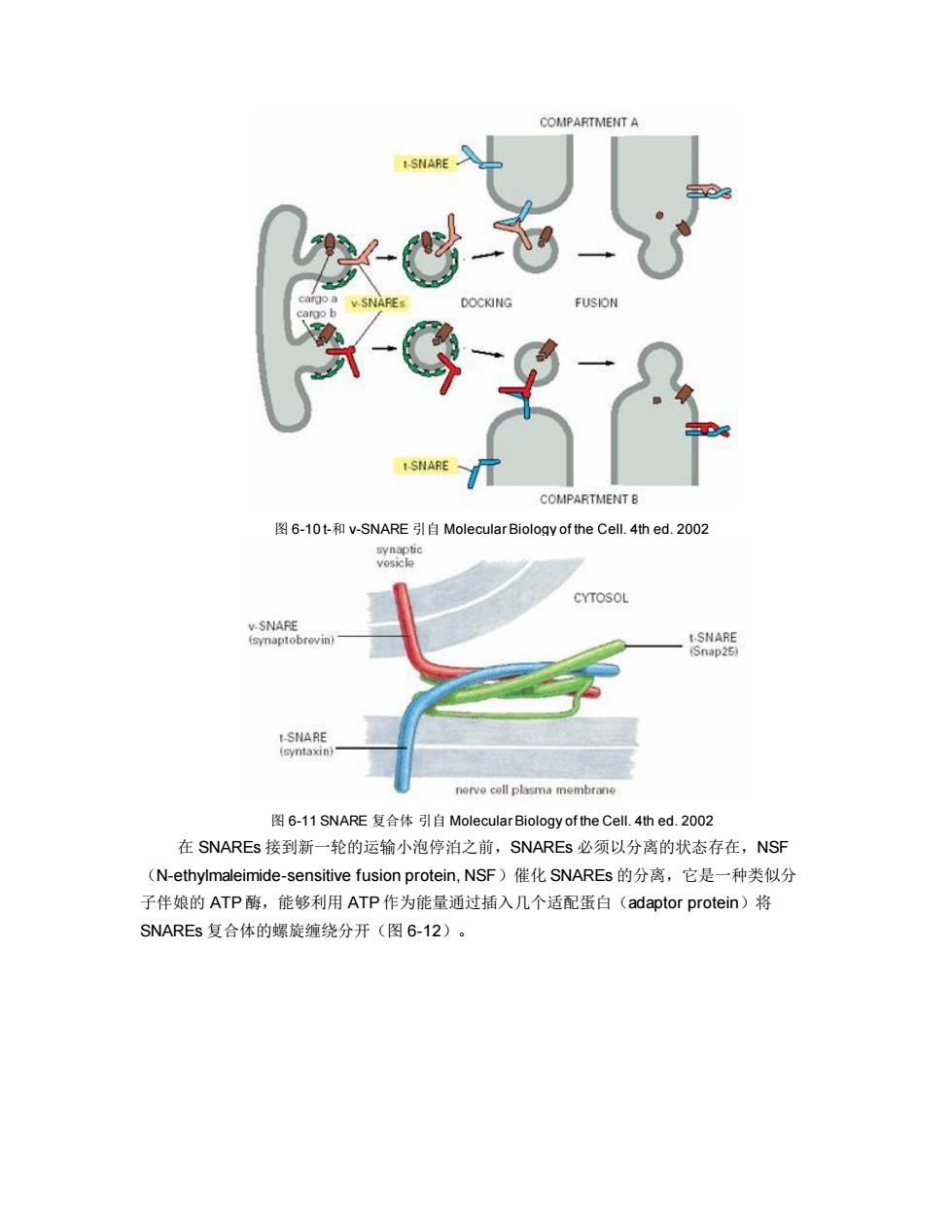
COMPARTMENT A I-SNARE DOCKING FUSION ISNARE COMPARTMENT B 图6-10t-和v-SNARE引自Molecular Biology of the Cel.4thed.2002 synaptic vesicle CYTOSOL v-SNARE (synaptobrevin) L-SNARE iSnap25) LSNARE (syntaxin) nerve cell plasma membrane 图6-11 SNARE复合体引自Molecular Biology of the Cell..4thed.2o02 在SNAREs接到新一轮的运输小泡停泊之前,SNAREs必须以分离的状态存在,NSF (N-ethylmaleimide-sensitive fusion protein,NSF)催化SNAREs的分离,它是一种类似分 子伴娘的ATP酶,能够利用ATP作为能量通过插入几个适配蛋白(adaptor protein)将 SNAREs复合体的螺旋缠绕分开(图6-12)
图 6-10 t-和 v-SNARE 引自 Molecular Biology of the Cell. 4th ed. 2002 图 6-11 SNARE 复合体 引自 Molecular Biology of the Cell. 4th ed. 2002 在 SNAREs 接到新一轮的运输小泡停泊之前,SNAREs 必须以分离的状态存在,NSF (N-ethylmaleimide-sensitive fusion protein, NSF)催化 SNAREs 的分离,它是一种类似分 子伴娘的 ATP 酶,能够利用 ATP 作为能量通过插入几个适配蛋白(adaptor protein)将 SNAREs 复合体的螺旋缠绕分开(图 6-12)
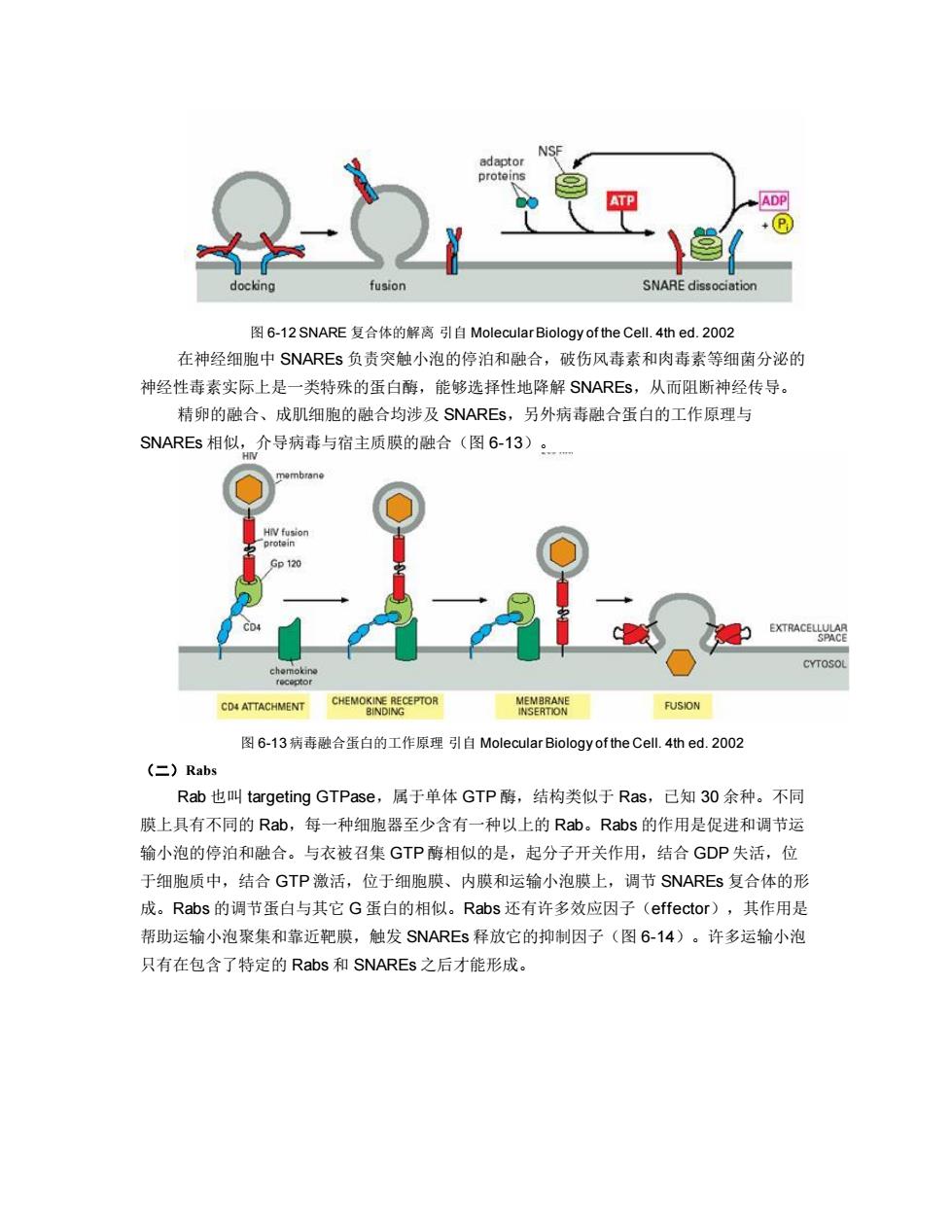
adaptor proteins ADP docking fusion SNARE dissociation 图6-12 SNARE复合体的解离引自Molecular Biology of the Cell.4thed.2002 在神经细胞中SNAREs负责突触小泡的停泊和融合,破伤风毒素和肉毒素等细菌分泌的 神经性毒素实际上是一类特殊的蛋白酶,能够选择性地降解SNAREs,从而阻断神经传导。 精卵的融合、成肌细胞的融合均涉及SNAREs,另外病毒融合蛋白的工作原理与 SNAREs相似,介导病毒与宿主质膜的融合(图6-13): H mbrane HIV fusion protein Gp120 EXTRACELLULAR SPACE CYTOSOL receptor CHEMOKINE RECEPTOR MEMBRANE CD4 ATTACHMENT BINDING INSERTION FUSION 图6-13病毒融合蛋白的工作原理引自Molecular Biology of the Cell..4thed.2002 (Rabs Rab也叫targeting GTPase,属于单体GTP酶,结构类似于Ras,己知30余种。不同 膜上具有不同的Rab,每一种细胞器至少含有一种以上的Rab。Rabs的作用是促进和调节运 输小泡的停泊和融合。与衣被召集GTP酶相似的是,起分子开关作用,结合GDP失活,位 于细胞质中,结合GTP激活,位于细胞膜、内膜和运输小泡膜上,调节SNAREs复合体的形 成。Rabs的调节蛋白与其它G蛋白的相似。Rabs还有许多效应因子(effector),其作用是 帮助运输小泡聚集和靠近靶膜,触发SNAREs释放它的抑制因子(图6-14)。许多运输小泡 只有在包含了特定的Rabs和SNAREs之后才能形成
图 6-12 SNARE 复合体的解离 引自 Molecular Biology of the Cell. 4th ed. 2002 在神经细胞中 SNAREs 负责突触小泡的停泊和融合,破伤风毒素和肉毒素等细菌分泌的 神经性毒素实际上是一类特殊的蛋白酶,能够选择性地降解 SNAREs,从而阻断神经传导。 精卵的融合、成肌细胞的融合均涉及 SNAREs,另外病毒融合蛋白的工作原理与 SNAREs 相似,介导病毒与宿主质膜的融合(图 6-13)。 图 6-13 病毒融合蛋白的工作原理 引自 Molecular Biology of the Cell. 4th ed. 2002 (二)Rabs Rab 也叫 targeting GTPase,属于单体 GTP 酶,结构类似于 Ras,已知 30 余种。不同 膜上具有不同的 Rab,每一种细胞器至少含有一种以上的 Rab。Rabs 的作用是促进和调节运 输小泡的停泊和融合。与衣被召集 GTP 酶相似的是,起分子开关作用,结合 GDP 失活,位 于细胞质中,结合 GTP 激活,位于细胞膜、内膜和运输小泡膜上,调节 SNAREs 复合体的形 成。Rabs 的调节蛋白与其它 G 蛋白的相似。Rabs 还有许多效应因子(effector),其作用是 帮助运输小泡聚集和靠近靶膜,触发 SNAREs 释放它的抑制因子(图 6-14)。许多运输小泡 只有在包含了特定的 Rabs 和 SNAREs 之后才能形成
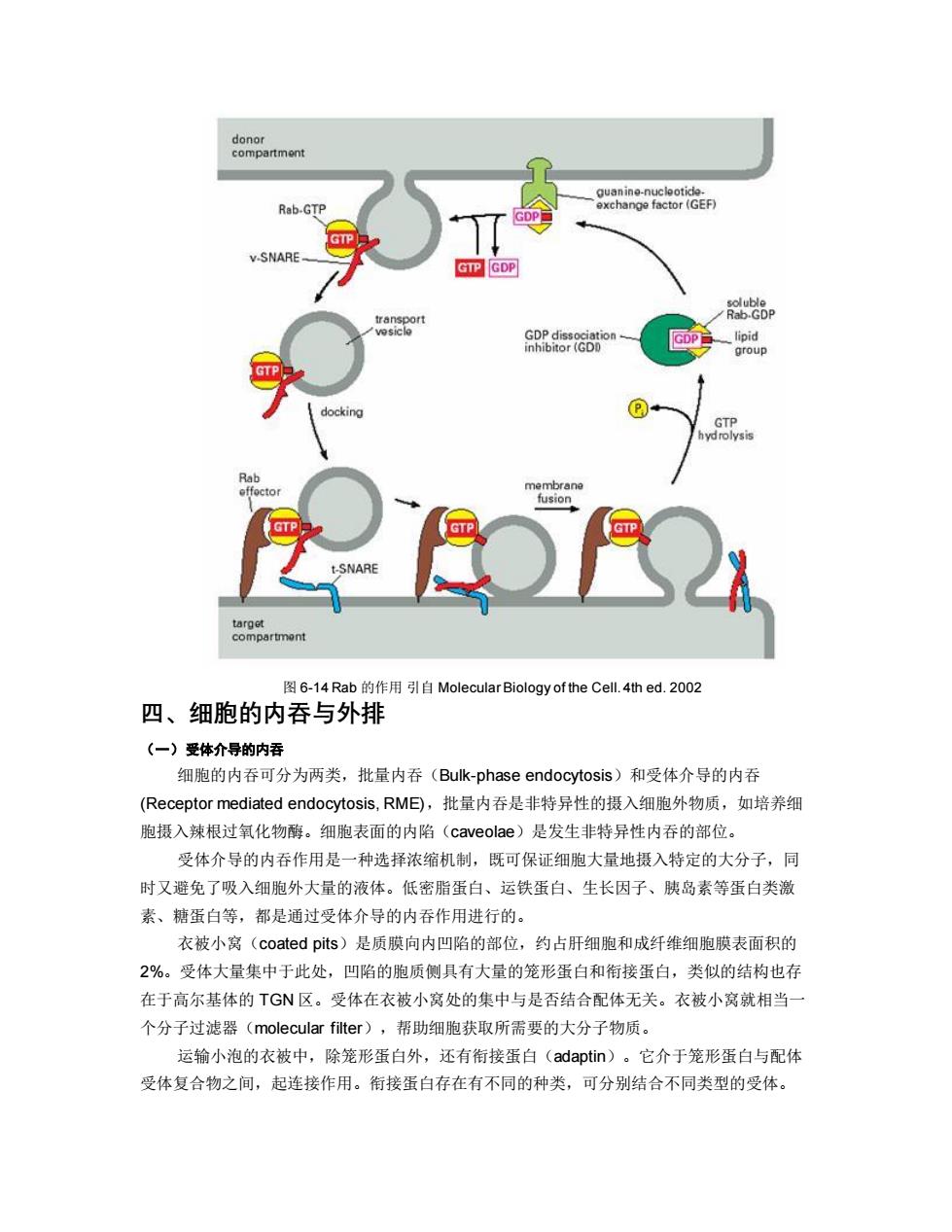
donor compartment guanine-nucleotice. Rab-GTP exchange factor(GEF) GTP V-SNARE GTP GDP soluble transport Rab.GDP GDP dissociation GDP lipid inhibitor(GDD group docking GTP hyd rolysis Rab offoctor membrane fusion GTP -SNARE target compartment 图6-14Rab的作用引自Molecular Biology of the Cell..4thed.2002 四、细胞的内吞与外排 (一)受体介导的内吞 细胞的内吞可分为两类,批量内吞(Bulk-phase endocytosis)和受体介导的内吞 (Receptor mediated endocytosis,RME),批量内吞是非特异性的摄入细胞外物质,如培养细 胞摄入辣根过氧化物酶。细胞表面的内陷(caveolae)是发生非特异性内吞的部位。 受体介导的内吞作用是一种选择浓缩机制,既可保证细胞大量地摄入特定的大分子,同 时又避免了吸入细胞外大量的液体。低密脂蛋白、运铁蛋白、生长因子、胰岛素等蛋白类激 素、糖蛋白等,都是通过受体介导的内吞作用进行的。 衣被小窝(coated pits)是质膜向内凹陷的部位,约占肝细胞和成纤维细胞膜表面积的 2%。受体大量集中于此处,凹陷的胞质侧具有大量的笼形蛋白和衔接蛋白,类似的结构也存 在于高尔基体的TGN区。受体在衣被小窝处的集中与是否结合配体无关。衣被小窝就相当一 个分子过滤器(molecular filter),帮助细胞获取所需要的大分子物质。 运输小泡的衣被中,除笼形蛋白外,还有衔接蛋白(adaptin)。它介于笼形蛋白与配体 受体复合物之间,起连接作用。衔接蛋白存在有不同的种类,可分别结合不同类型的受体
图 6-14 Rab 的作用 引自 Molecular Biology of the Cell. 4th ed. 2002 四、细胞的内吞与外排 (一)受体介导的内吞 细胞的内吞可分为两类,批量内吞(Bulk-phase endocytosis)和受体介导的内吞 (Receptor mediated endocytosis, RME),批量内吞是非特异性的摄入细胞外物质,如培养细 胞摄入辣根过氧化物酶。细胞表面的内陷(caveolae)是发生非特异性内吞的部位。 受体介导的内吞作用是一种选择浓缩机制,既可保证细胞大量地摄入特定的大分子,同 时又避免了吸入细胞外大量的液体。低密脂蛋白、运铁蛋白、生长因子、胰岛素等蛋白类激 素、糖蛋白等,都是通过受体介导的内吞作用进行的。 衣被小窝(coated pits)是质膜向内凹陷的部位,约占肝细胞和成纤维细胞膜表面积的 2%。受体大量集中于此处,凹陷的胞质侧具有大量的笼形蛋白和衔接蛋白,类似的结构也存 在于高尔基体的 TGN 区。受体在衣被小窝处的集中与是否结合配体无关。衣被小窝就相当一 个分子过滤器(molecular filter),帮助细胞获取所需要的大分子物质。 运输小泡的衣被中,除笼形蛋白外,还有衔接蛋白(adaptin)。它介于笼形蛋白与配体 受体复合物之间,起连接作用。衔接蛋白存在有不同的种类,可分别结合不同类型的受体