
(一)笼形蛋白衣被小泡 笼形蛋白衣被小泡是最早发现的衣被小泡,介导高尔基体到内体、溶酶体、植物液泡的 运输,以及质膜到内膜区隔的膜泡运输。 笼形蛋白分子由3个重链和3个轻链组成(图6-2),形成一个具有3个曲臂的形状 (triskelion)。许多笼形蛋白的曲臂部分交织在一起,形成一个具有5边形网孔的笼子(图6 3)。 heavy chain light chain (C) 防nm 图6-2笼形蛋白的结构,A电镜照片,B分子模型,C衣被模型引自Molecular Biology of the Cell.4th ed.2002
(一)笼形蛋白衣被小泡 笼形蛋白衣被小泡是最早发现的衣被小泡,介导高尔基体到内体、溶酶体、植物液泡的 运输,以及质膜到内膜区隔的膜泡运输。 笼形蛋白分子由 3 个重链和 3 个轻链组成(图 6-2),形成一个具有 3 个曲臂的形状 (triskelion)。许多笼形蛋白的曲臂部分交织在一起,形成一个具有 5 边形网孔的笼子(图 6- 3)。 图 6-2 笼形蛋白的结构,A 电镜照片,B 分子模型,C 衣被模型 引自 Molecular Biology of the Cell. 4th ed. 2002

0.2um 图6-3笼形蛋白衣被小泡的形态 笼形蛋白形成的衣被中还有衔接蛋白(adaptin)。它介于笼形蛋白与配体受体复合物之 间,起连接作用(图6-4)。目前至少发现4种不同类型的衔接蛋白,可分别结合不同类型的 受体,形成不同性质的转运小泡,如AP1参与高尔基体→内体的运输、AP2参与质膜→内体 的运输、AP3参与高尔基体→溶酶体的运输
图 6-3 笼形蛋白衣被小泡的形态 笼形蛋白形成的衣被中还有衔接蛋白(adaptin)。它介于笼形蛋白与配体受体复合物之 间,起连接作用(图 6-4)。目前至少发现 4 种不同类型的衔接蛋白,可分别结合不同类型的 受体,形成不同性质的转运小泡,如 AP1 参与高尔基体→内体的运输、AP2 参与质膜→内体 的运输、AP3 参与高尔基体→溶酶体的运输
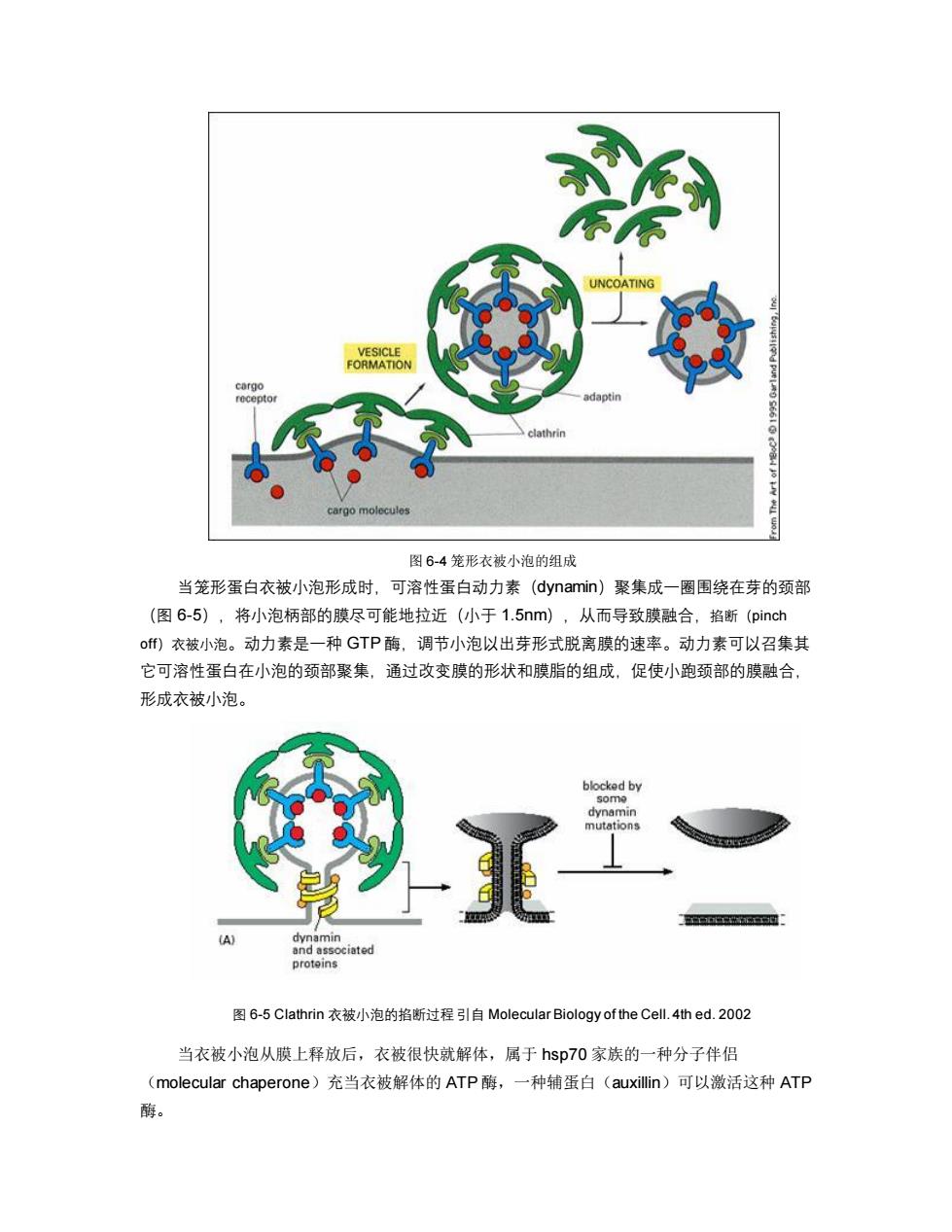
UNCOATING VESICLE FORMATION cargo receptor adaptin clathrin cargo molecules 图6-4笼形衣被小泡的组成 当笼形蛋白衣被小泡形成时,可溶性蛋白动力素(dynamin)聚集成一圈围绕在芽的颈部 (图6-5),将小泡柄部的膜尽可能地拉近(小于1.5nm),从而导致膜融合,掐断(pinch o)衣被小泡。动力素是一种GTP酶,调节小泡以出芽形式脱离膜的速率。动力素可以召集其 它可溶性蛋白在小泡的颈部聚集,通过改变膜的形状和膜脂的组成,促使小跑颈部的膜融合, 形成衣被小泡。 blocked by dynamin 工c (A) dynamin and associated proteins 图6-5 Clathrin衣被小泡的掐断过程引自Molecular Biology of the Cell.4thed.2002 当衣被小泡从膜上释放后,衣被很快就解体,属于hsp70家族的一种分子伴侣 (molecular chaperone)充当衣被解体的ATP酶,一种辅蛋白(auxillin)可以激活这种ATP 酶
图 6-4 笼形衣被小泡的组成 当笼形蛋白衣被小泡形成时,可溶性蛋白动力素(dynamin)聚集成一圈围绕在芽的颈部 (图 6-5),将小泡柄部的膜尽可能地拉近(小于 1.5nm),从而导致膜融合,掐断(pinch off)衣被小泡。动力素是一种 GTP 酶,调节小泡以出芽形式脱离膜的速率。动力素可以召集其 它可溶性蛋白在小泡的颈部聚集,通过改变膜的形状和膜脂的组成,促使小跑颈部的膜融合, 形成衣被小泡。 图 6-5 Clathrin 衣被小泡的掐断过程 引自 Molecular Biology of the Cell. 4th ed. 2002 当衣被小泡从膜上释放后,衣被很快就解体,属于 hsp70 家族的一种分子伴侣 (molecular chaperone)充当衣被解体的 ATP 酶,一种辅蛋白(auxillin)可以激活这种 ATP 酶
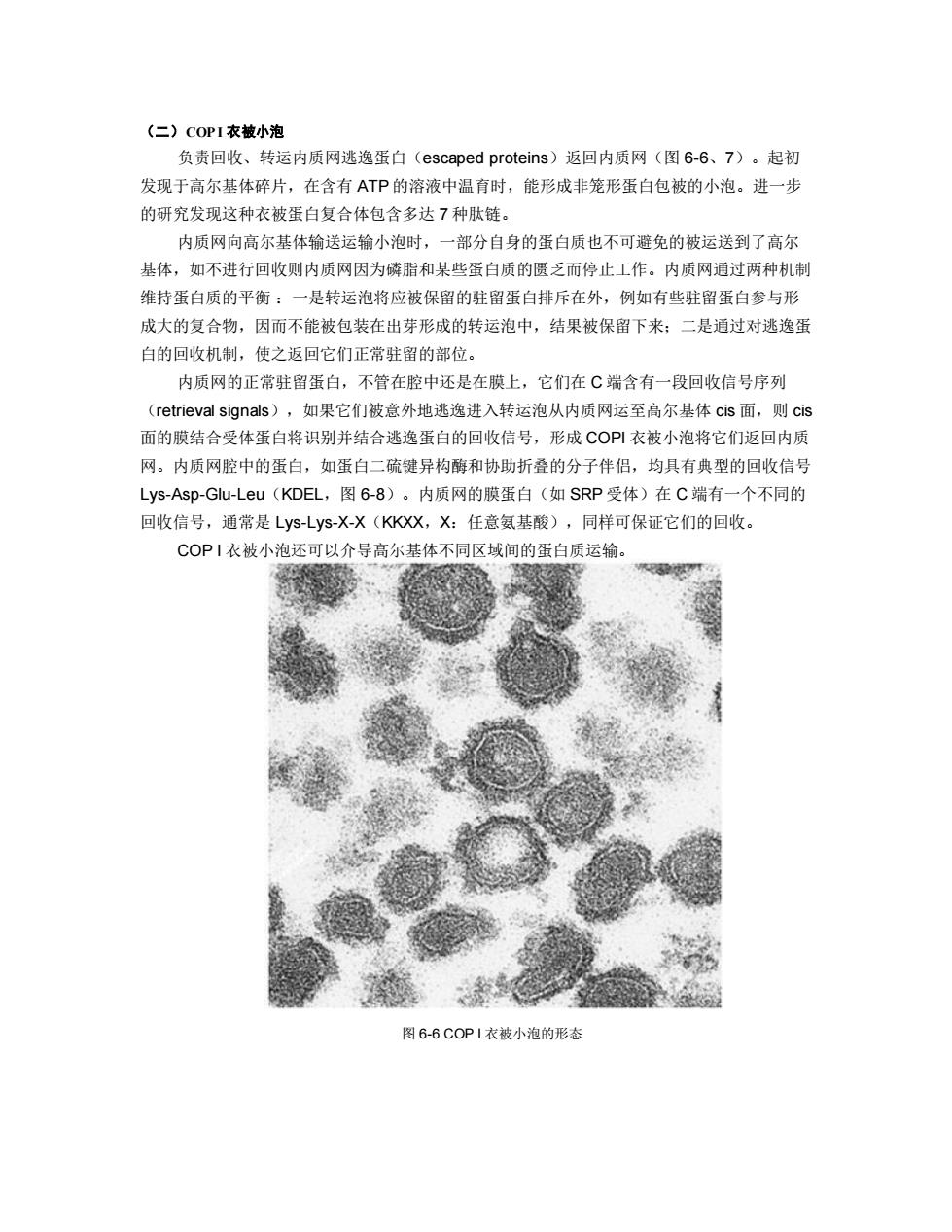
(二)COPI衣被小泡 负责回收、转运内质网逃逸蛋白(escaped proteins)返回内质网(图6-6、7)。起初 发现于高尔基体碎片,在含有ATP的溶液中温育时,能形成非笼形蛋白包被的小泡。进一步 的研究发现这种衣被蛋白复合体包含多达7种肽链。 内质网向高尔基体输送运输小泡时,一部分自身的蛋白质也不可避免的被运送到了高尔 基体,如不进行回收则内质网因为磷脂和某些蛋白质的匮乏而停止工作。内质网通过两种机制 维持蛋白质的平衡:一是转运泡将应被保留的驻留蛋白排斥在外,例如有些驻留蛋白参与形 成大的复合物,因而不能被包装在出芽形成的转运泡中,结果被保留下来:二是通过对逃逸蛋 白的回收机制,使之返回它们正常驻留的部位。 内质网的正常驻留蛋白,不管在腔中还是在膜上,它们在C端含有一段回收信号序列 (retrieval signals),如果它们被意外地逃逸进入转运泡从内质网运至高尔基体cis面,则cis 面的膜结合受体蛋白将识别并结合逃逸蛋白的回收信号,形成COP!衣被小泡将它们返回内质 网。内质网腔中的蛋白,如蛋白二硫键异构酶和协助折叠的分子伴侣,均具有典型的回收信号 LyS-Asp-Glu-Leu(KDEL,图6-8)。内质网的膜蛋白(如SRP受体)在C端有一个不同的 回收信号,通常是Lys-Lys-X-X(KKXX,X:任意氨基酸),同样可保证它们的回收。 COPI衣被小泡还可以介导高尔基体不同区域间的蛋白质运输。 图6-6COPI衣被小泡的形态
(二)COP I 衣被小泡 负责回收、转运内质网逃逸蛋白(escaped proteins)返回内质网(图 6-6、7)。起初 发现于高尔基体碎片,在含有 ATP 的溶液中温育时,能形成非笼形蛋白包被的小泡。进一步 的研究发现这种衣被蛋白复合体包含多达 7 种肽链。 内质网向高尔基体输送运输小泡时,一部分自身的蛋白质也不可避免的被运送到了高尔 基体,如不进行回收则内质网因为磷脂和某些蛋白质的匮乏而停止工作。内质网通过两种机制 维持蛋白质的平衡 :一是转运泡将应被保留的驻留蛋白排斥在外,例如有些驻留蛋白参与形 成大的复合物,因而不能被包装在出芽形成的转运泡中,结果被保留下来;二是通过对逃逸蛋 白的回收机制,使之返回它们正常驻留的部位。 内质网的正常驻留蛋白,不管在腔中还是在膜上,它们在 C 端含有一段回收信号序列 (retrieval signals),如果它们被意外地逃逸进入转运泡从内质网运至高尔基体 cis 面,则 cis 面的膜结合受体蛋白将识别并结合逃逸蛋白的回收信号,形成 COPI 衣被小泡将它们返回内质 网。内质网腔中的蛋白,如蛋白二硫键异构酶和协助折叠的分子伴侣,均具有典型的回收信号 Lys-Asp-Glu-Leu(KDEL,图 6-8)。内质网的膜蛋白(如 SRP 受体)在 C 端有一个不同的 回收信号,通常是 Lys-Lys-X-X(KKXX,X:任意氨基酸),同样可保证它们的回收。 COP I 衣被小泡还可以介导高尔基体不同区域间的蛋白质运输。 图 6-6 COP I 衣被小泡的形态
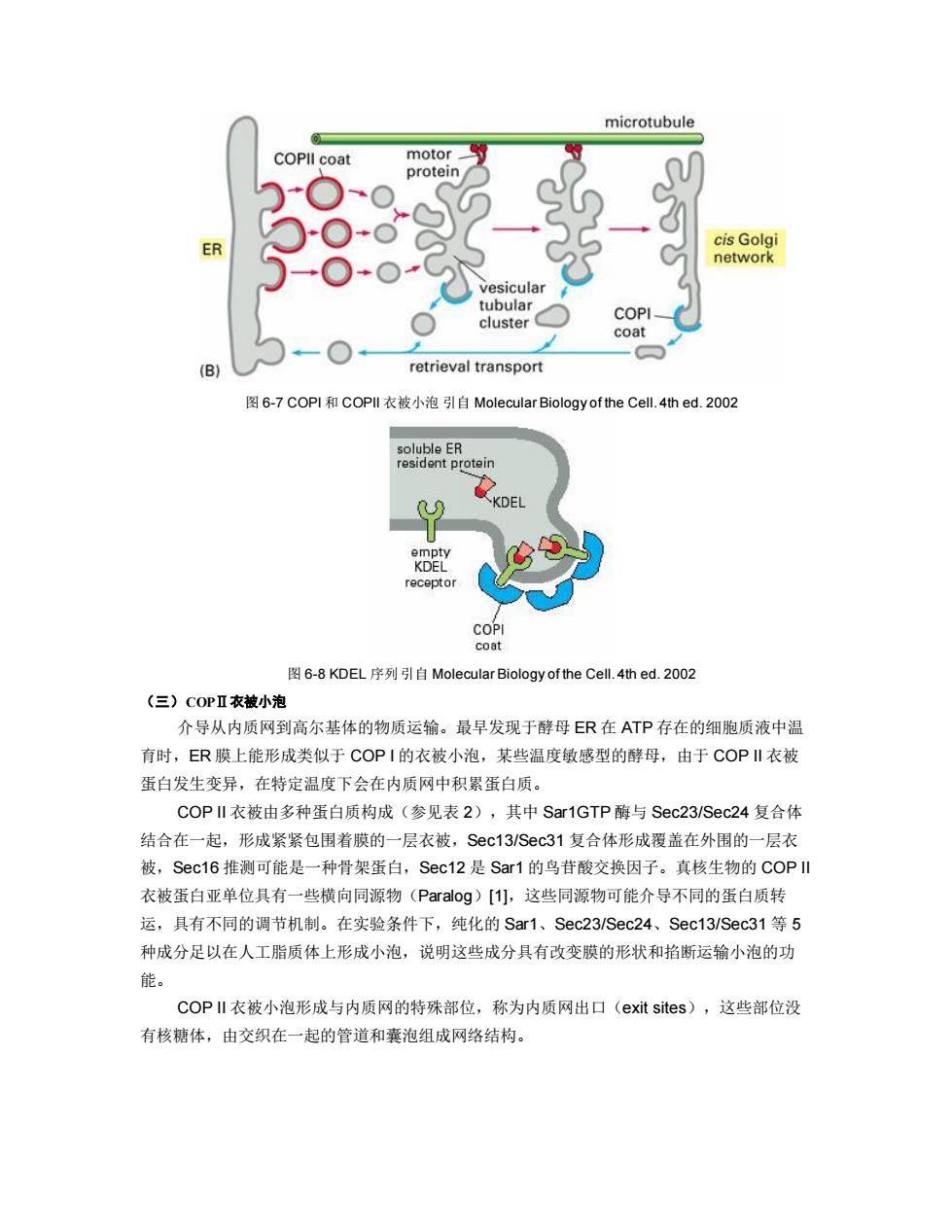
microtubule COPll coat motor protein cis Golgi ER network vesicular tubular COPI_ cluster coat (B) retrieval transport 图6-7COPI和COPI‖衣被小泡引自Molecular Biology of the Cell.4thed.2002 soluble ER resident protein KDEL empty KDEL receptor COPI coat 图6-8KDEL序列引自Molecular Biology of the Cell.4thed.2002 (三)COPⅡ衣被小泡 介导从内质网到高尔基体的物质运输。最早发现于酵母ER在ATP存在的细胞质液中温 育时,ER膜上能形成类似于COPI的衣被小泡,某些温度敏感型的酵母,由于COPI衣被 蛋白发生变异,在特定温度下会在内质网中积累蛋白质。 COP II衣被由多种蛋白质构成(参见表2),其中Sar1GTP酶与Sec23/Sec24复合体 结合在一起,形成紧紧包围着膜的一层衣被,Sec13/Sec31复合体形成覆盖在外围的一层衣 被,Sec16推测可能是一种骨架蛋白,Sec12是Sar1的鸟苷酸交换因子。真核生物的COP川 衣被蛋白亚单位具有一些横向同源物(Paralog)[1],这些同源物可能介导不同的蛋白质转 运,具有不同的调节机制。在实验条件下,纯化的Sar1、Sec23/Sec24、Sec13/Sec31等5 种成分足以在人工脂质体上形成小泡,说明这些成分具有改变膜的形状和掐断运输小泡的功 能。 COPI衣被小泡形成与内质网的特殊部位,称为内质网出口(exit sites),这些部位没 有核糖体,由交织在一起的管道和囊泡组成网络结构
图 6-7 COPI 和 COPII 衣被小泡 引自 Molecular Biology of the Cell. 4th ed. 2002 图 6-8 KDEL 序列 引自 Molecular Biology of the Cell. 4th ed. 2002 (三)COPⅡ衣被小泡 介导从内质网到高尔基体的物质运输。最早发现于酵母 ER 在 ATP 存在的细胞质液中温 育时,ER 膜上能形成类似于 COP I 的衣被小泡,某些温度敏感型的酵母,由于 COP II 衣被 蛋白发生变异,在特定温度下会在内质网中积累蛋白质。 COP II 衣被由多种蛋白质构成(参见表 2),其中 Sar1GTP 酶与 Sec23/Sec24 复合体 结合在一起,形成紧紧包围着膜的一层衣被,Sec13/Sec31 复合体形成覆盖在外围的一层衣 被,Sec16 推测可能是一种骨架蛋白,Sec12 是 Sar1 的鸟苷酸交换因子。真核生物的 COP II 衣被蛋白亚单位具有一些横向同源物(Paralog)[1],这些同源物可能介导不同的蛋白质转 运,具有不同的调节机制。在实验条件下,纯化的 Sar1、Sec23/Sec24、Sec13/Sec31 等 5 种成分足以在人工脂质体上形成小泡,说明这些成分具有改变膜的形状和掐断运输小泡的功 能。 COP II 衣被小泡形成与内质网的特殊部位,称为内质网出口(exit sites),这些部位没 有核糖体,由交织在一起的管道和囊泡组成网络结构