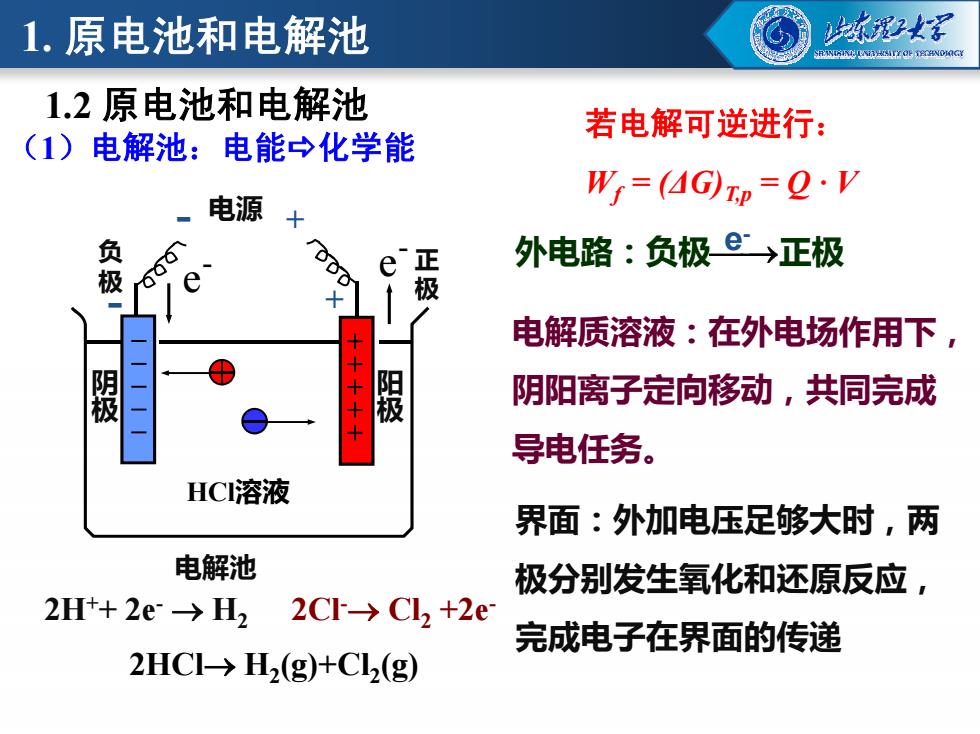
1.原电池和电解池 强2 1.2原电池和电解池 若电解可逆进行: (1)电解池:电能→化学能 W=(4Gp=Q·V 电源 负 正 外电路:负极©→正极 极 电解质溶液:在外电场作用下, 被 阴阳离子定向移动,共同完成 导电任务。 HCI溶液 界面:外加电压足够大时,两 电解池 极分别发生氧化和还原反应, 2H+2e→H2 2C→Cl2+2e 完成电子在界面的传递 2HC→H2(g)+Cl2(g)
- 电源 + + - e - e - 电解质溶液:在外电场作用下, (1)电解池:电能化学能 1.2 原电池和电解池 负 极 正 极 若电解可逆进行: Wf = (ΔG)T,p = Q · V - - + + 外电路:负极e 正极 - 1. 原电池和电解池 HCl溶液 电解池 阴阳离子定向移动,共同完成 导电任务。 2HCl H2(g)+Cl2(g) 2Cl- Cl2 +2e- 2H++ 2e- H2 阴极 阳极 界面:外加电压足够大时,两 极分别发生氧化和还原反应, 完成电子在界面的传递 - - - - + + + +
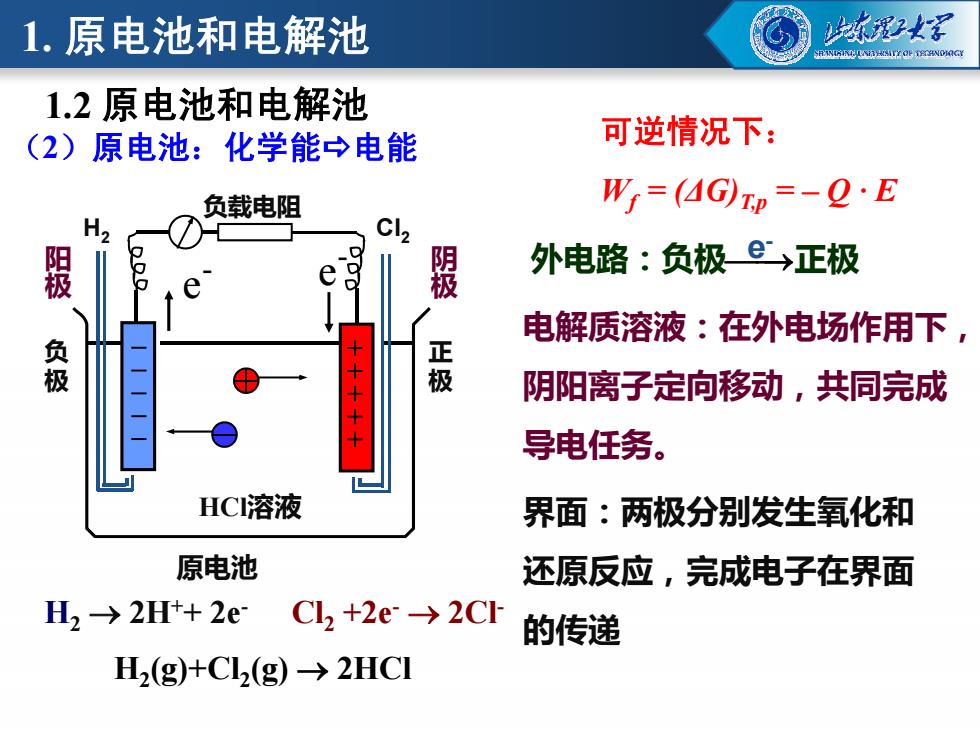
1.原电池和电解池 2螺 BININLNIHSITL OF TEDRNONGY 1.2原电池和电解池 (2)原电池:化学能→电能 可逆情况下: 负载电阻 W=(4Gp=-Q·E 阳 外电路:负极e→正极 程 电解质溶液:在外电场作用下, 正 阴阳离子定向移动,共同完成 导电任务。 HC溶液 界面:两极分别发生氧化和 原电池 还原反应,完成电子在界面 H2>2H++2e Cl2+2e→2CI 的传递 H2(g)+C2(g)→2HCI
(2)原电池:化学能电能 - e - e 负 极 正 极 阳极 阴极 负载电阻 H2 Cl2 电解质溶液:在外电场作用下, 阴阳离子定向移动,共同完成 可逆情况下: Wf = (ΔG)T,p = – Q · E - - + + 外电路:负极e 正极 - 1.2 原电池和电解池 1. 原电池和电解池 HCl溶液 原电池 极 极 H2(g)+Cl2(g) 2HCl Cl2 +2e- 2Cl H - 2 2H++ 2e- 阴阳离子定向移动,共同完成 导电任务。 界面:两极分别发生氧化和 还原反应,完成电子在界面 的传递 - - - - + + + +
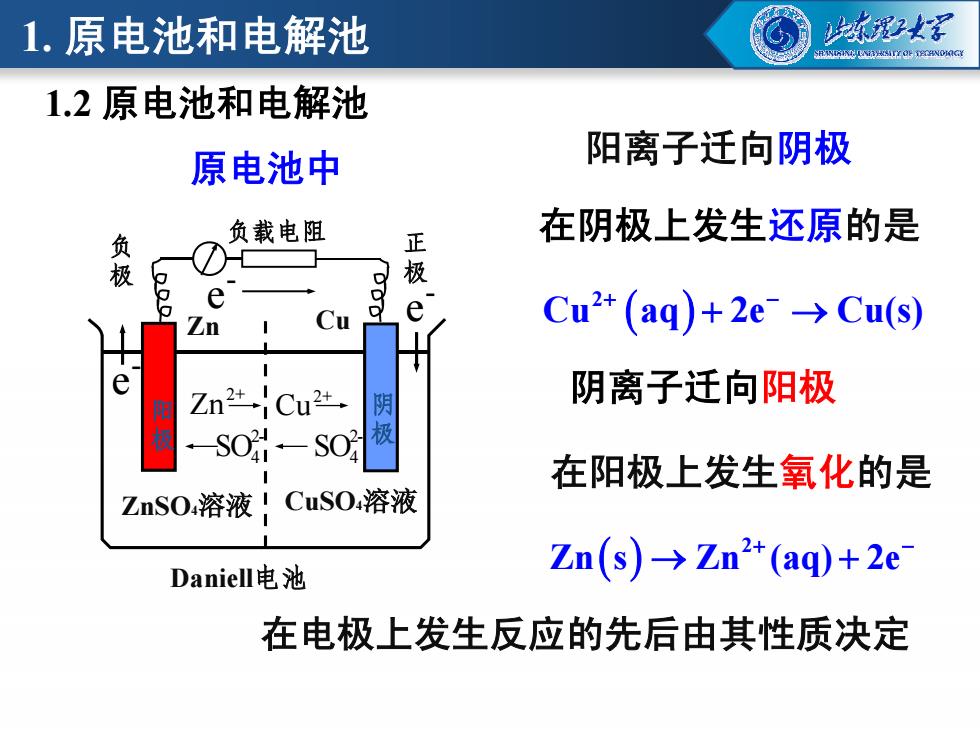
1.原电池和电解池 强2 1.2原电池和电解池 原电池中 阳离子迁向阴极 在阴极上发生还原的是 负 负载电阻 正 极 极 e e Cu Cu2+(aq)+2e→>Cus) Zn Cu2 阴 阴离子迁向阳极 S0- SO 在阳极上发生氧化的是 ZnSO溶液!CuSO溶液 Daniell电池 Zn(s→Zn2+(aq)+2e 在电极上发生反应的先后由其性质决定
阳离子迁向阴极 负载电阻 正 极 负 极 Zn Cu - e - e - e 在阴极上发生还原的是 2 Cu aq 2e Cu(s) 原电池中 1.2 原电池和电解池 1. 原电池和电解池 阴离子迁向阳极 ZnSO4溶液 阳 极 CuSO4溶液 阴 极 Daniell电池 - e 2+ Zn 2+ Cu 2- SO4 2- SO4 2 Zn s Zn (aq) 2e 在阳极上发生氧化的是 在电极上发生反应的先后由其性质决定
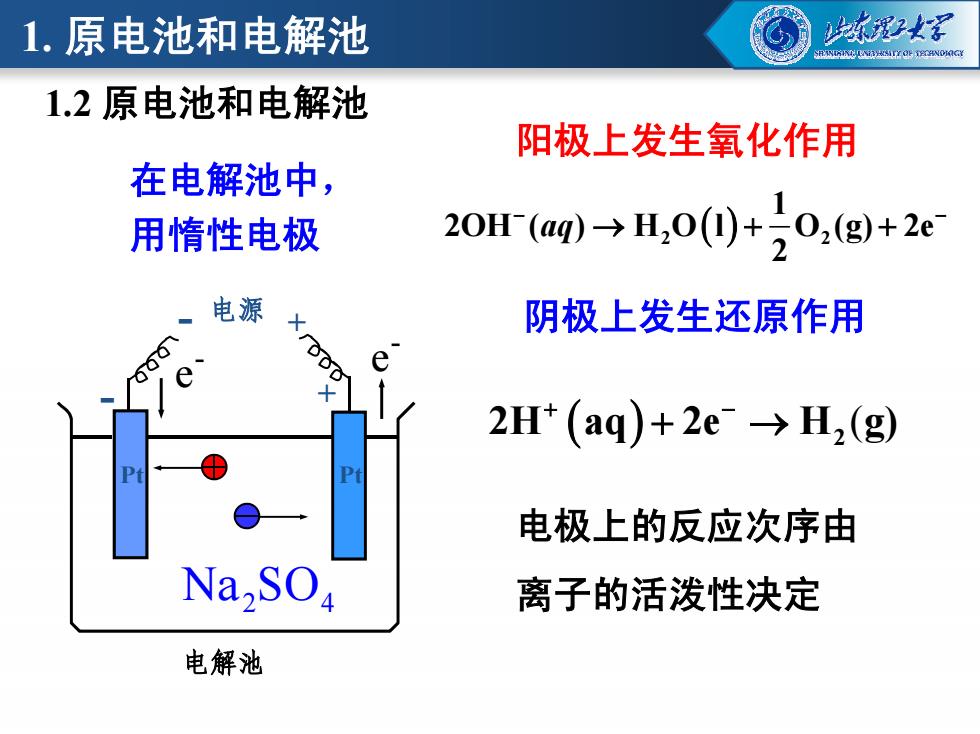
1.原电池和电解池 2星 INILNIHITLOF TECRNONGY 1.2原电池和电解池 阳极上发生氧化作用 在电解池中, 用惰性电极 20r(aq)-→,0(0)+20,(g+2e 电源 阴极上发生还原作用 e 2H*(aq)+2e→H,(g) 电极上的反应次序由 Na,SO 离子的活泼性决定 电解池
阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 用惰性电极 - 电源 + - e - e 2 2 1 2OH ( ) H O l O (g) 2e 2 aq 1.2 原电池和电解池 1. 原电池和电解池 电解池 + Pt - e e - Pt Na SO2 4 (2 2H aq 2e H g) 电极上的反应次序由 离子的活泼性决定

2.Faraday电解定律 冰强2 Faraday归纳了多次实验结果,于1833年 总结出了电解定律 (1)在电极界面上发生化学变化的物质的 量与通入的电荷量成正比。 (2)若将几个电解池串联,通入一定的电 荷量后,在各个电解池的电极上发生化学变 化的物质的量相等
2. Faraday电解定律 Faraday 归纳了多次实验结果,于1833年 总结出了电解定律 (1)在电极界面上发生化学变化的物质的 量与通入的电荷量成正比。 (2)若将几个电解池串联,通入一定的电 荷量后,在各个电解池的电极上发生化学变 化的物质的量相等