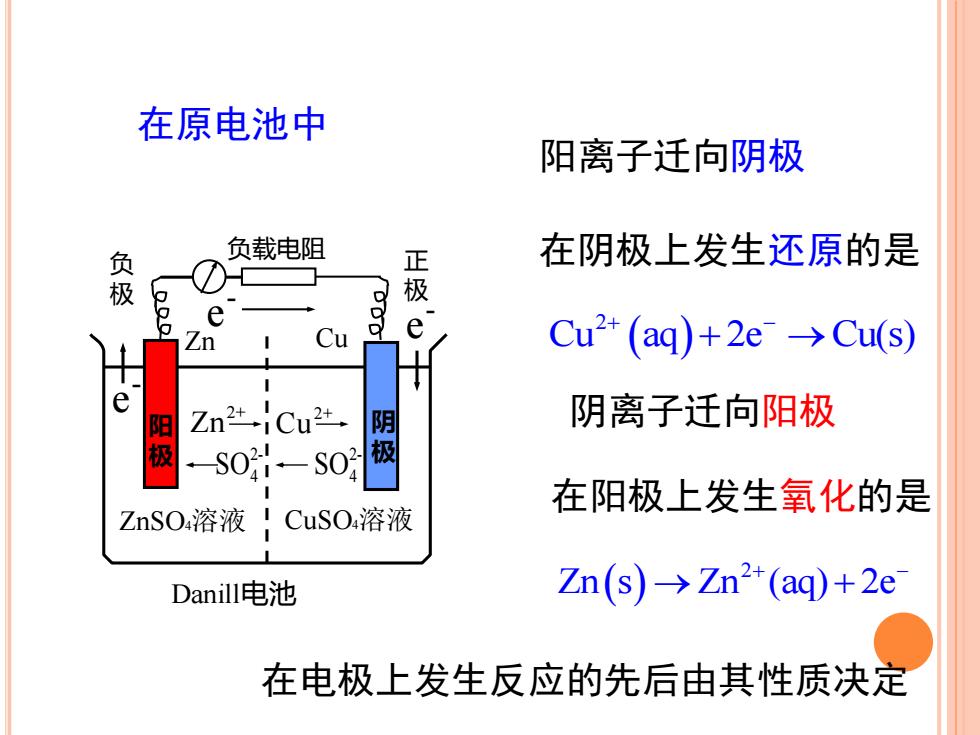
在原电池中阳离子迁向阴极负载电阻在阴极上发生还原的是正极负极OeeCu2+ (aq)+2e →Cu(s)CuZn++e阴离子迁向阳极Zn2+阳极-iCu2+阴极-02-SO-SO在阳极上发生氧化的是CuSO4溶液ZnSO4溶液Zn(s)→Zn2+(aq)+2eDanill电池在电极上发生反应的先后由其性质决定
阳离子迁向阴极 阴离子迁向阳极 在原电池中 负载电阻 正 极 负 极 Zn ZnSO4溶液 阳 极 Cu CuSO4溶液 阴 极 Danill电池 - e - e - e 2+ Zn 2+ Cu 2- SO4 2- SO4 在阴极上发生还原的是 ( ) 2 Zn s Zn (aq) 2e → + + − ( ) 2 Cu aq 2e Cu(s) + − + → 在阳极上发生氧化的是 在电极上发生反应的先后由其性质决定
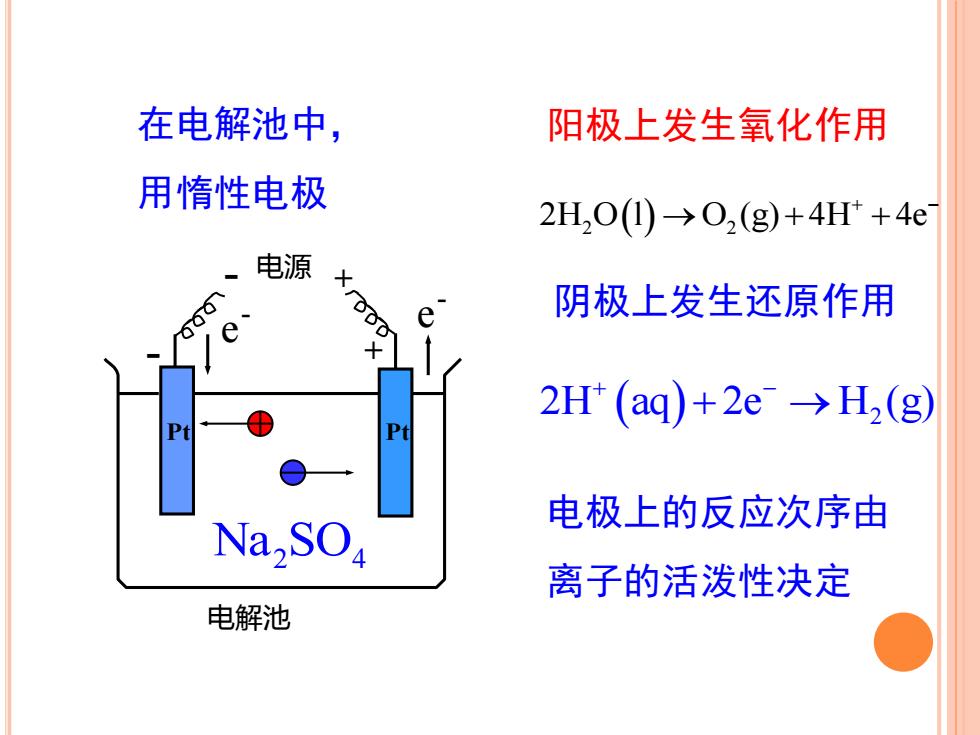
在电解池中,阳极上发生氧化作用用惰性电极2H,0(1) →0,(g)+4H+ + 4e电源xrg阴极上发生还原作用eQe+2H+(aq)+2e →H,(g)PtPt电极上的反应次序由Na,SO离子的活泼性决定电解池
阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 用惰性电极 - 电源 + 电解池 + Pt - e - e - Pt Na SO2 4 2H O l O (g) 4H 4e 2 2 ( ) → + ++ − 2H aq 2e H (g) ( ) 2 + − + → 电极上的反应次序由 离子的活泼性决定
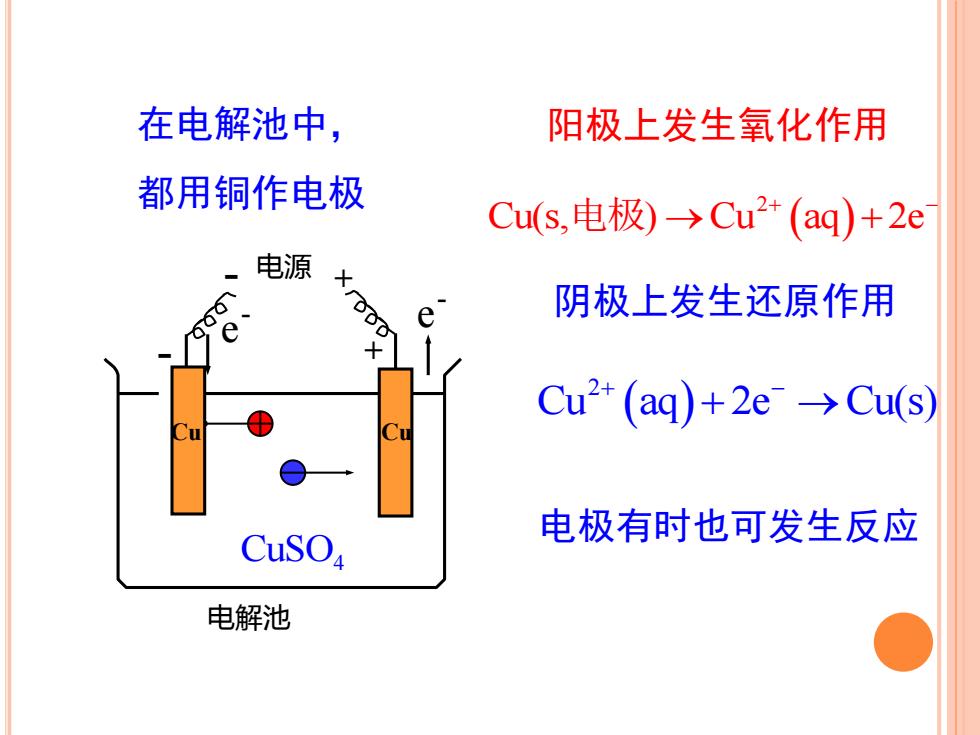
在电解池中,阳极上发生氧化作用都用铜作电极Cu(s,电极)→Cu2+(aq)+2e电源xrg阴极上发生还原作用ee+Cu2 (aq)+2e" →Cu(s)Cu1电极有时也可发生反应CusO电解池
阳极上发生氧化作用 阴极上发生还原作用 在电解池中, 都用铜作电极 - 电源 + 电解池 + Cu - e - e - Cu CuSO4 ( ) 2 Cu aq 2e Cu(s) + − + → 电极有时也可发生反应 ( ) 2 Cu(s, ) Cu aq 2e 电极 → + + −

FARADAY电解定律Faraday!归纳了多次实验结果,于1833年总结出了电解定律1.在电极上(两相界面上)物质发生化学变化的物质的量与通入的电荷量成正比。2.若将几个电解池串联,通入一定的电荷量后在各个电极上发生化学变化的物质的量都相等(当所取的基本粒子的荷电数相同时,在各个电极上发生反应的物质,其物质的量相同,析出物质的质量与其摩尔质量成正比。)
FARADAY电解定律 Faraday 归纳了多次实验结果,于1833年 总结出了电解定律 ⒈ 在电极上(两相界面上)物质发生化学 变化的物质的量与通入的电荷量成正比。 ⒉ 若将几个电解池串联,通入一定的电荷量后, 在各个电极上发生化学变化的物质的量都相等。 (当所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析出物 质的质量与其摩尔质量成正比。)

人们把在数值上等于1mol元电荷的电量称为Faraday常数。已知元电荷电量e为1.6022 ×10-19 CF=Le= 6.022 ×1023 mol ×1.602 2 × 10-19 C= 96 484.6 C·mol-1~ 96 500 C·mol-1
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。 已知元电荷电量 e 为 19 1.6022 10 C − F L e = 23 19 6.022 10 mol 1.602 2 10 C − = 1 96 484.6 C mol− = 1 96 500 C mol−