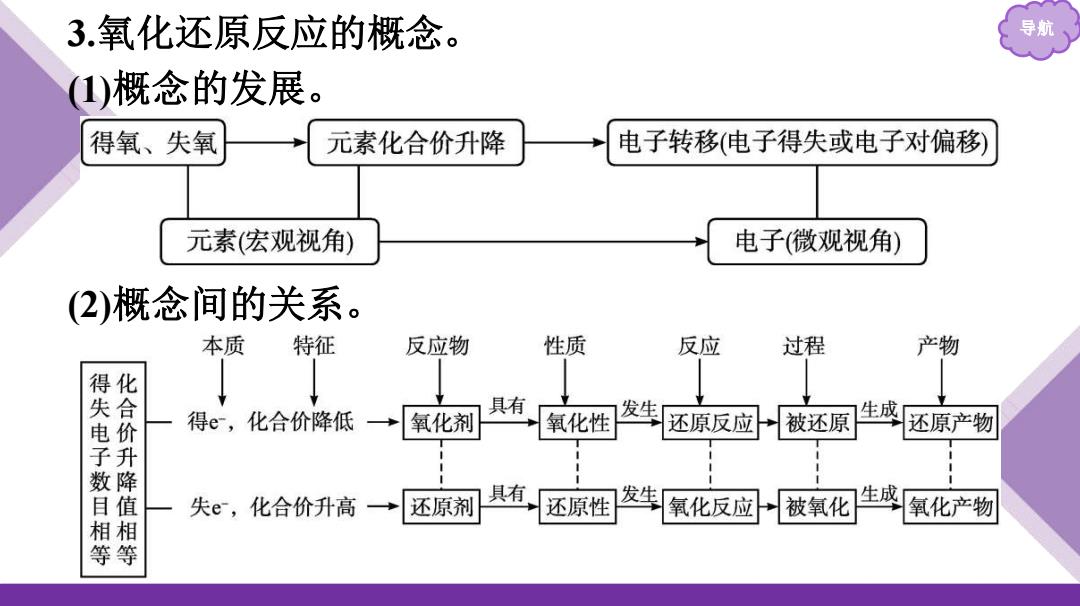
3.氧化还原反应的概念。 导 (1)概念的发展 得氧、失氧 元素化合价升降 电子转移(电子得失或电子对偏移 元素(宏观视角) 电子(微观视角) (2)概念间的关系 。 本质 特征 反应物 性质 反应 过程 产物 得化 失合 得e,化合价降低→ 具有 氧化剂 氧化性 发生 生成 电价 还原反应 被还原 还原产物 子升 数降 目值 失e,化合价升高→ 还原剂 具有 还原性 发生 氧化反应 被氧化 生成 氧化产物 相相 等等
导航 3.氧化还原反应的概念。 (1)概念的发展。 (2)概念间的关系

导航 专题归纳突破 专题一离子共存问题 所谓几种离子在同一溶液中能大量共存,就是指离子之间不 发生任何反应,若离子之间能发生反应,则不能大量共存
导航 专题归纳突破 专题一 离子共存问题 所谓几种离子在同一溶液中能大量共存,就是指离子之间不 发生任何反应,若离子之间能发生反应,则不能大量共存

1.离子间发生的反应类型。 (1)复分解反应。 ①生成难溶物或微溶物:如Ba2+与C0子、Ag与C、Ca2+与S0子 等不能大量共存。 ②生成气体物质:如H(足量)与C0子等不能大量共存。 ③生成弱酸、弱碱、水等物质:如H+与CH,COO生成弱酸、 H+与OH生成水。 (2)氧化还原反应。 具有较强氧化性的离子(如F3+)与还原性离子(如)不能犬 量共存
导航 1.离子间发生的反应类型。 (1)复分解反应。 ①生成难溶物或微溶物:如 Ba2+与 C𝐎𝟑 𝟐- 、Ag+ 与 Cl- 、Ca2+与 S𝐎𝟒 𝟐- 等不能大量共存。 ②生成气体物质:如 H+ (足量)与 C𝐎𝟑 𝟐- 等不能大量共存。 ③生成弱酸、弱碱、水等物质:如H+与CH3COO-生成弱酸、 H+与OH-生成水。 (2)氧化还原反应。 具有较强氧化性的离子(如Fe3+)与还原性离子(如I - )不能大 量共存

导 2.有限制条件的离子共存问题。 (1)酸性溶液(H)、碱性溶液(OH)等,酸性溶液中能与H+反 应的离子不能大量共存,碱性溶液中能与OH反应的离子不能 大量共存。 (2)无色溶液中,有色离子Mn04(紫色)、Fe3+(黄色)、Fe2+(浅 绿色)、Cu2+(蓝色)等不能大量存在。 (3)注意题目要求“大量共存还是“不能大量共存
导航 2.有限制条件的离子共存问题。 (1)酸性溶液(H+ )、碱性溶液(OH- )等,酸性溶液中能与H+反 应的离子不能大量共存,碱性溶液中能与OH-反应的离子不能 大量共存。 (2)无色溶液中,有色离子 (紫色)、Fe3+(黄色)、Fe2+(浅 绿色)、Cu2+(蓝色)等不能大量存在。 (3)注意题目要求“大量共存”还是“不能大量共存” 。 Mn𝐎𝟒 -