
HAC 式, Co 表明,弱酸的电离度(Q)近似与其初始浓度(c)成反比, 即浓度越小,电离度就越大,我们把这种关系就做稀释定律。 弱碱的情况与之类似。 弱酸的电离平衡常数(K。)和电离度(α)都可以用来表示 弱酸的相对强弱,但是电离度(Q)会随着初始浓度(c)的变 化而变化:电离平衡常数(K,)则不受初始浓度(c)的影响。 弱碱的情况与之类似
0 c KHAc 式, = 表明,弱酸的电离度( α )近似与其初始浓度( c0 )成反比, 即浓度越小,电离度就越大,我们把这种关系就做稀释定律。 弱碱的情况与之类似。 弱酸的电离平衡常数( Ka )和电离度( α )都可以用来表示 弱酸的相对强弱,但是电离度( α )会随着初始浓度( c0 )的变 化而变化;电离平衡常数( Ka )则不受初始浓度( c0 )的影响。 弱碱的情况与之类似

【弱酸溶液氢离子浓度的求算】以醋酸为例: HAc H* Ac 初始浓度 Co 0 0 电离平衡 CHAC Co-x CH=X 时的浓度 Ac- 。x·x CHAC Co-x HAc是一 co>500 电离平衡常数(KAc)很小 个很弱的酸 KHAc 则/C-X≈C,→KHc≈ Co
【弱酸溶液氢离子浓度的求算】以醋酸为例: 电离平衡 时的浓度 c c x HAc = 0 − c x Ac− = 初始浓度 0 c 0 0 c x H + = HAc H Ac HAc H Ac HAc c c c K + − = c x x x− = 0 500 0 KHAc c HAc 是一 电离平衡常数( KHAc )很小 个很弱的酸 0 0 则 c − x c 0 2 c x KHAc KHAc x c 0 H KHAc c c + 0

【例3.1】试计算浓度为0.10mol.L1的NH4CI溶液中的H+ 浓度及溶液的pH。 解:将NH4CI看做一个弱酸,查表,可知NHCI的电离平衡 常数为 KwHt=5.65x1010 NH,C1的电离平衡常数很小,是一个弱酸,存在以下电离平衡 NH4+≥H++ NH: 初始浓度/ Co 0 0 电离平衡 CNH =C0-X CH=X CNH=X 时的浓度 Co>500 K NH
【例3.1】试计算浓度为 0.10 mol.L-1 的 NH4Cl 溶液中的 H+ 浓度及溶液的 pH 。 解:将 NH4Cl 看做一个弱酸,查表,可知 NH4Cl 的电离平衡 常数为 10 5.65 10 4 − + = NH K NH4 H NH3 NH4Cl 的电离平衡常数很小,是一个弱酸,存在以下电离平衡 电离平衡 时的浓度 c c x NH + = 0 − 4 c x H + = 初始浓度 0 c 0 0 c x NH = 3 500 4 0 + NH K c + + 4 H 0 NH c c K
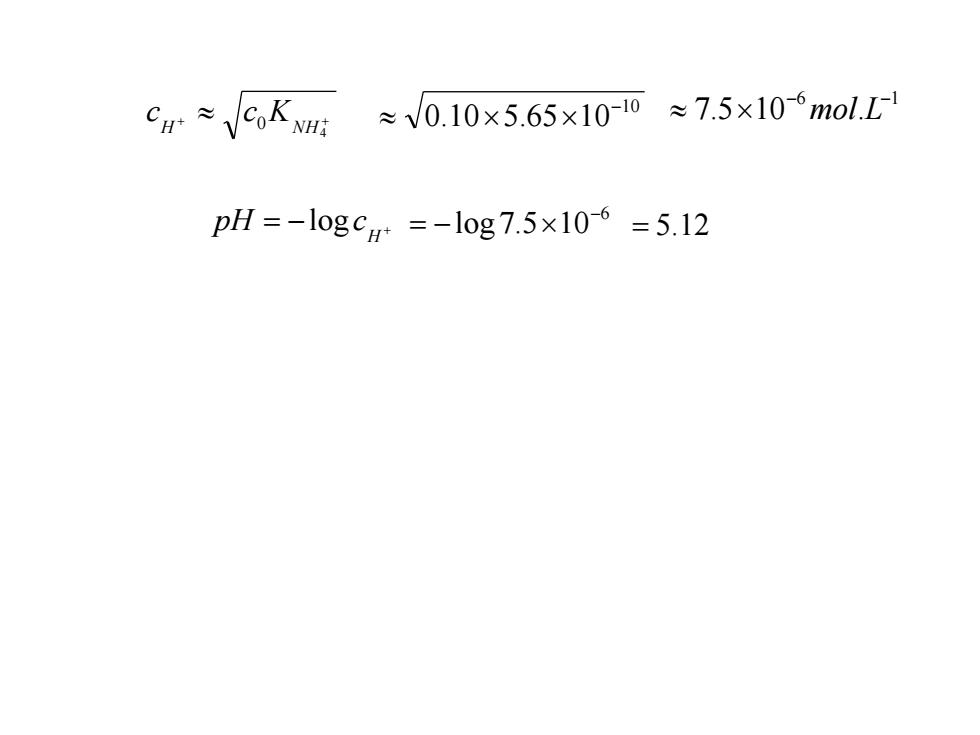
≈/0.10×5.65×1010≈7.5×10-6mol.L1 pH=-logc+=-log7.5×106=5.12
+ + 4 H 0 NH c c K 10 0.10 5.65 10− 6 1 7.5 10 . − − mol L = − + H pH logc 6 log 7.5 10− = − = 5.12
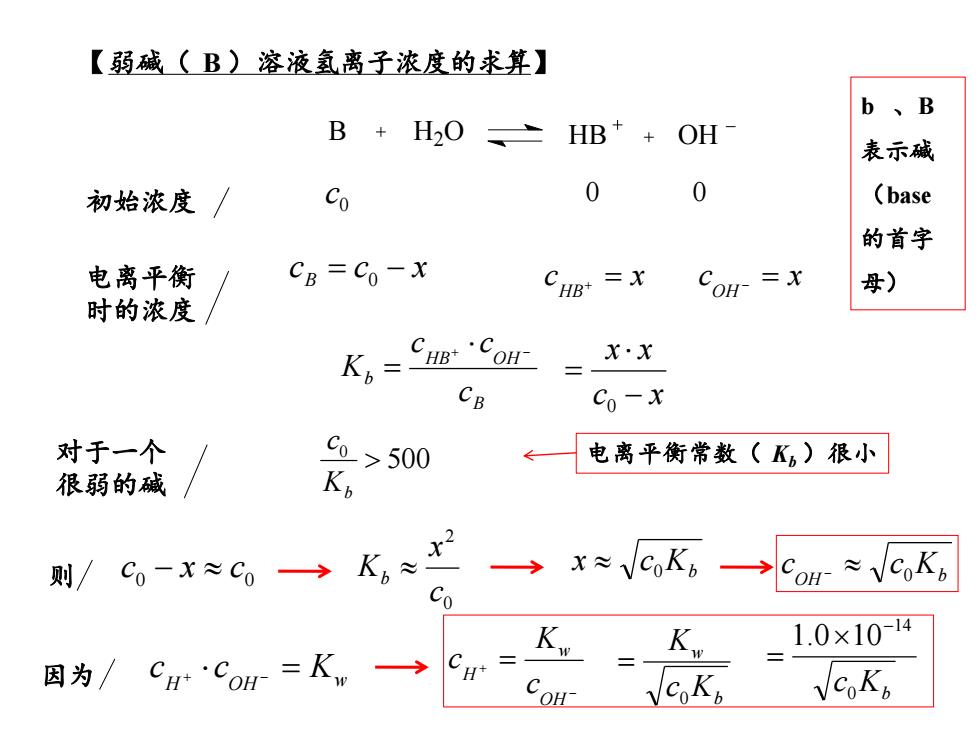
【弱碱(B)溶液氢离子浓度的求箕】 b、B B+H20之 HB*+OH 表示碱 初始浓度 Co 0 0 (base 的首字 电离平衡 CB=Co-x CHB=X CoH- =x 母) 时的浓度 K.=Cum'Con X·x CB Co-x 对于一个 co>500 电离平衡常数(K)很小 很弱的碱 则/ →x≈VcK。→Com≈VK) Co 因为/ C*CO=Kw→ CH' K=K,=1.0×104 COH YCoK. CoKp
B H2O HB OH 电离平衡 时的浓度 c c x B = 0 − c x OH − = 初始浓度 0 c 0 0 c x HB+ = B HB OH b c c c K + − = c x x x− = 0 500 0 Kb c 对于一个 电离平衡常数( Kb )很小 很弱的碱 0 0 则 c − x c 0 2 c x Kb Kb x c 0 OH Kb c c − 0 因为 H OH Kw c + c − = − + = OH w H c K c b w c K K 0 = Kb c0 14 1.0 10− = 【弱碱( B )溶液氢离子浓度的求算】 b 、B 表示碱 (base 的首字 母)