
三、半波电位与标淮电极电位 的关系 1,p12与p基本相等,均相0一R反应,如 果R,p12<p°或O,p12>p,不可逆 2.p12p°,M+ne→MHg) M与Hg的 亲和力大,碱金属与碱土金属(Na,Li, K,Ca,Mg) 3.p2<p,不形成MHg)。由于过电位存 在,p2<φ°,如Fe2+,Co2+,Ni2+等
三、半波电位与标准电极电位 的关系 1.1/2与 基本相等,均相O—R反应,如 果 R, 1/2< 或O, 1/2> ,不可逆 2.1/2> ,Mn++ne→M(Hg) M与Hg的 亲和力大,碱金属与碱土金属(Na, Li, K, Ca, Mg) 3. 1/2< ,不形成M(Hg)。由于过电位存 在,1/2< ,如Fe2+, Co2+, Ni2+等
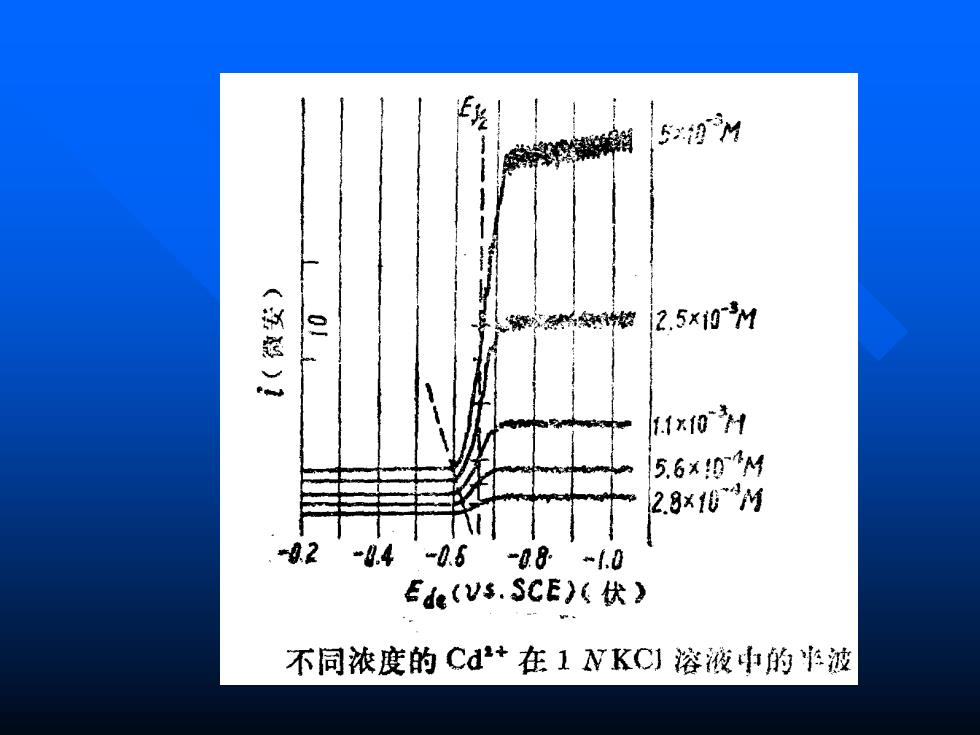
5理 2.5x0M 1x101 5.6×0M 2.8×eM *02 -8.4-0.6-08“1.0 Ede(Vs.SCE)(伏) 不同浓度的Cd+在1NKC1溶液中的波

§5一4极谱催化波与络合吸附波 电极与化学反应的情况可以分为三类: 1.化学反应先于电极反应AB化学反应 B+ne→C电极反应 前行动力波 2.化学反应与电极反应同时进行 A+ne→B 电极反应B+C→A化学反应平行动力波 3.化学反应常后于电极反应A+ne→B 电极反应 B→C化学反应随后动力波 着眼于平行反应,2号产生极谱催化波的基础: ①O,一Ra型 ②催化氢波
§5—4 极谱催化波与络合吸附波 电极与化学反应的情况可以分为三类: 1.化学反应先于电极反应 A → B 化学反应 B+ne-→C 电极反应 前行动力波 2.化学反应与电极反应同时进行 A+ne-→B 电极反应 B+C → A 化学反应 平行动力波 3.化学反应常后于电极反应 A+ne-→B 电极反应 B → C 化学反应 随后动力波 着眼于平行反应,2号产生极谱催化波的基础: ①Ox—Red型 ②催化氢波

氧化一还原反应型催化波 (平行催化波被) 1.反应机理:O+neR 电极 R+Z→O氧化—还原 O:为什么可以作为催化剂
一、氧化—还原反应型催化波 (平行催化波) 1.反应机理:O + ne-→R 电极 R+Z → O 氧化—还原 O:为什么可以作为催化剂

2.特点:①O作为催化剂,其本身含量不变, 消耗的是“Z” ②“Z”本身可以在电极上还原,但过电位很 大,有很强的氧化性。 ③催化电流受反应物质扩散速度控制外, 也受R+Z→→O反应速率控制。 ④均相反应,“O”应是变价化合物。 3.DME上电流方程式: i。=0.51nFD2m23t2k2e,2c。 :催化电流 cz,c。:物质“z”,“o”的溶液浓 度 D: “o”的扩散系数。k:化学反应常数
2.特点:①O作为催化剂,其本身含量不变, 消耗的是“Z” ②“Z”本身可以在电极上还原,但过电位很 大,有很强的氧化性。 ③催化电流受反应物质扩散速度控制外, 也受R+Z → O反应速率控制。 ④均相反应,“O”应是变价化合物。 3.DME上电流方程式: i c=0.51nFD1/2m2/3t 2/3k 1/2cz 1/2co i c:催化电流 cz,co:物质“z”,“o”的溶液浓 度 D:“o”的扩散系数。 k:化学反应常数