
1.4共价键 有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合 1.4.1共价键的形成 离子键的形成: 一个或更多的电子从一个原子转移到 另一个原子形成离子时产生的键。 它是带有相反电荷的质体间的吸引力。 Na汽)->Na气)+e Cl气)+e- C气) Na气)+ Cl气)NaCl气
1.4 共价键 有机化合物中典型的化学键:共价键 有机化合物的共同结构特征:共价键结合 1.4.1 共价键的形成 离子键的形成: 一个或更多的电子从一个原子转移到 另一个原子形成离子时产生的键。 它是带有相反电荷的质体间的吸引力。 Na (气 ) Na(气 ) + e Cl(气 ) + e Cl(气 ) Na (气 ) + Cl(气 ) Na Cl(气 )
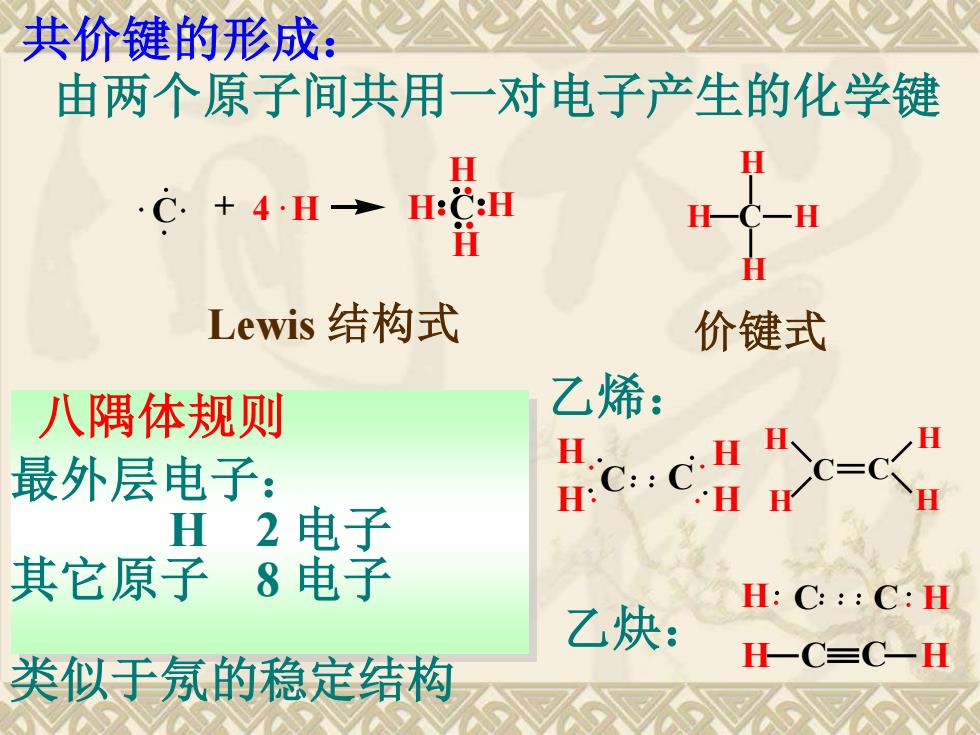
共价键的形成: 由两个原子间共用一对电子产生的化学键 H H C.+4.H-H:C:H 一C-H H Lewis结构式 价键式 八隅体规则 乙烯: 最外层电子: H2电子 其它原子8电子 H:C:::C:H 乙炔: 一CC一H 类似手氖的稳定结构
共价键的形成: 由两个原子间共用一对电子产生的化学键 C + 4 H C H H H H H C H H H Lewis 结构式 价键式 八隅体规则 最外层电子: H 2 电子 其它原子 8 电子 类似于氖的稳定结构 乙烯: C H H C H H C C H H H H 乙炔: H C C H H C C H
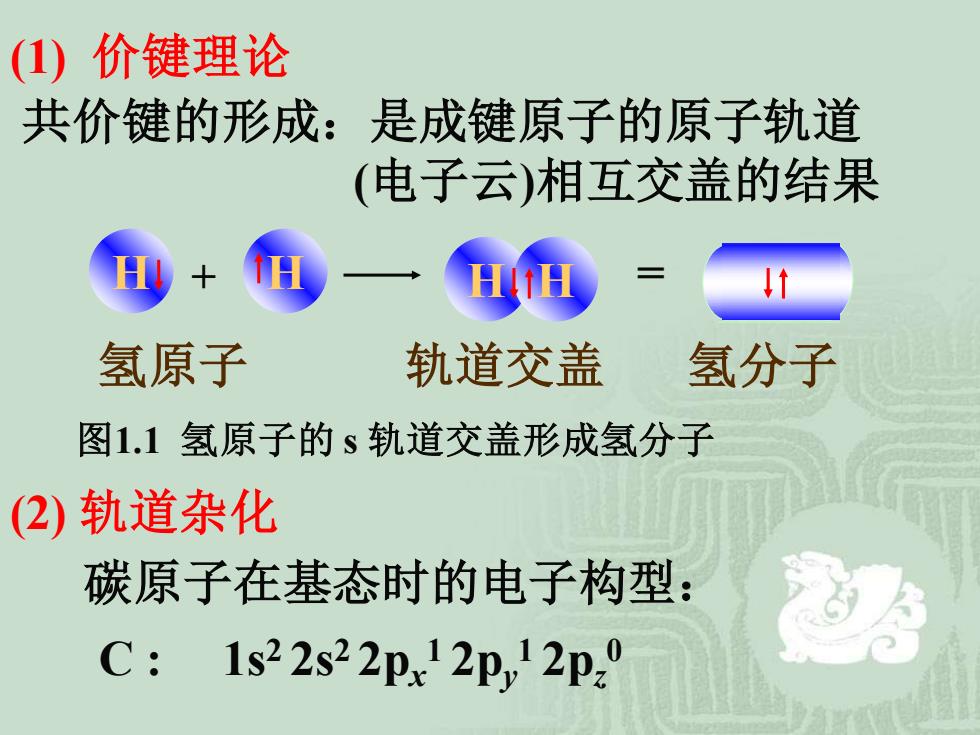
(1)价键理论 共价键的形成:是成键原子的原子轨道 (电子云)相互交盖的结果 氢原子 轨道交盖 氢分子 图1.1氢原子的s轨道交盖形成氢分子 (2)轨道杂化 碳原子在基态时的电子构型: C: 1s22s22px2p,12p
(1) 价键理论 共价键的形成:是成键原子的原子轨道 (电子云)相互交盖的结果 (2) 轨道杂化 C : 1s2 2s2 2px 1 2py 1 2pz 0 碳原子在基态时的电子构型: H + H H H = 氢原子 轨道交盖 氢分子 图1.1 氢原子的 s 轨道交盖形成氢分子
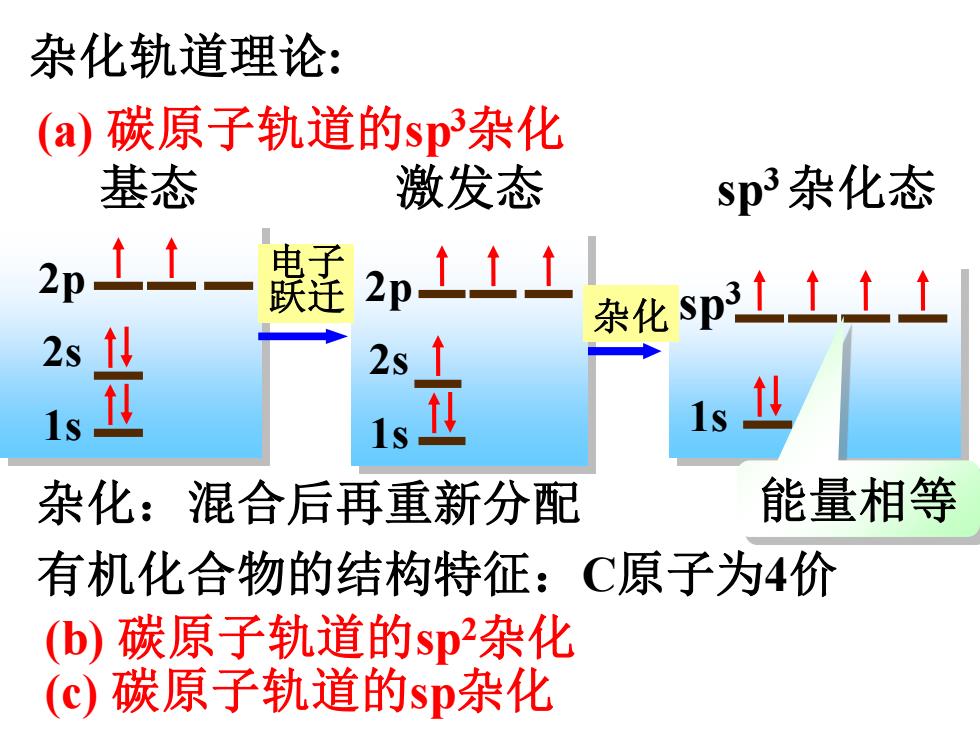
杂化轨道理论: (a)碳原子轨道的sp杂化 基态 激发态 sp3杂化态 2p11- 2pt11 杂化sp3士t土1 2s1: 1s Is 杂化:混合后再重新分配 能量相等 有机化合物的结构特征:C原子为4价 (b)碳原子轨道的sp杂化 (c)碳原子轨道的sp杂化
杂化轨道理论: 基态 2p 2s 1s 激发态 2p 2s 1s sp3 杂化态 1s sp3 杂化 杂化:混合后再重新分配 能量相等 (a) 碳原子轨道的sp3杂化 (b) 碳原子轨道的sp2杂化 (c) 碳原子轨道的sp杂化 电子 跃迁 有机化合物的结构特征:C原子为4价
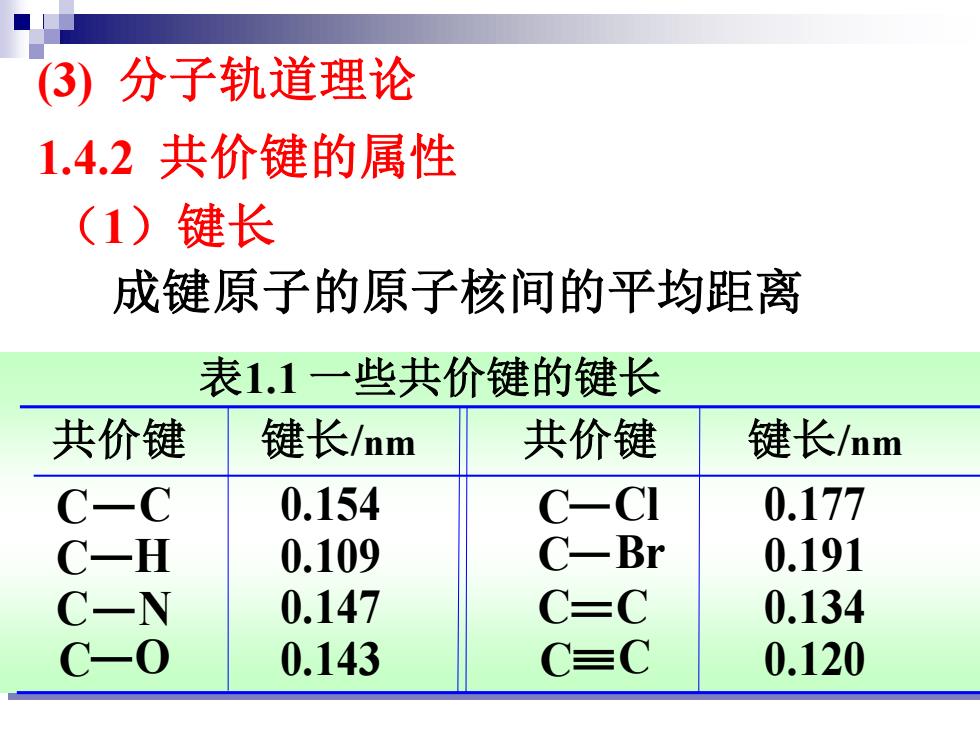
(3)分子轨道理论 1.4.2共价键的属性 (1)键长 成键原子的原子核间的平均距离 表1.1一些共价键的键长 共价键 键长/nm 共价键 键长/nm -C 0.154 C-CI 0.177 一H 0.109 C一Br 0.191 -N 0.147 C-C 0.134 -0 0.143 C=C 0.120
共价键 键长/nm 共价键 键长/nm C C C H C N C O 0.154 0.109 0.147 0.143 C Cl C Br C C C C 0.177 0.191 0.134 0.120 表1.1 一些共价键的键长 成键原子的原子核间的平均距离 (3) 分子轨道理论 1.4.2 共价键的属性 (1)键长