
4.1化学反应速率理论基础 4.1.2化学反应速率理论简介 1.碰撞理论一气体双分子间的反应 基本假设: (①)反应物分子发生碰撞是反应进行的先决条件,反 应物分子碰撞的频率越高,反应速率越快: (2)分子碰撞必须具备一定的能量和方位,才能发 生有效碰撞 一化学反应
1. 碰撞理论——气体双分子间的反应 (1) 反应物分子发生碰撞是反应进行的先决条件,反 应物分子碰撞的频率越高,反应速率越快; 基本假设: 4.1.2 化学反应速率理论简介 4.1 化学反应速率理论基础 (2)分子碰撞必须具备一定的能量和方位,才能发 生 有 效 碰 撞 ——化学反应
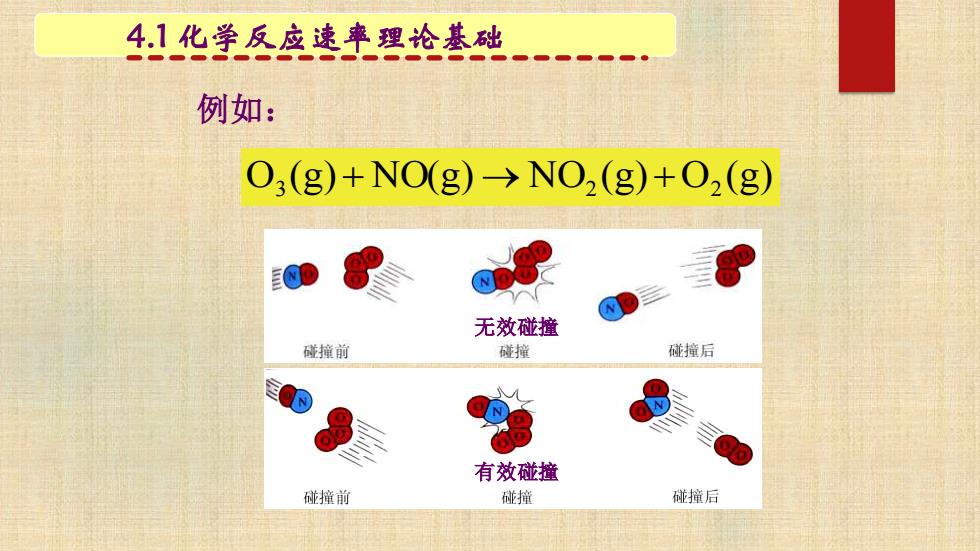
4.1化学反应速率理论基础 例如: O;(g)+NO(g)->NO2 (g)+2(g) 无效碰撞 碰撞前 碰撞 碰撞后 有效碰撞 碰撞前 碰撞 碰撞后
例如: O (g) NO(g) NO (g) O (g) 3 + → 2 + 2 4.1 化学反应速率理论基础 无效碰撞 有效碰撞
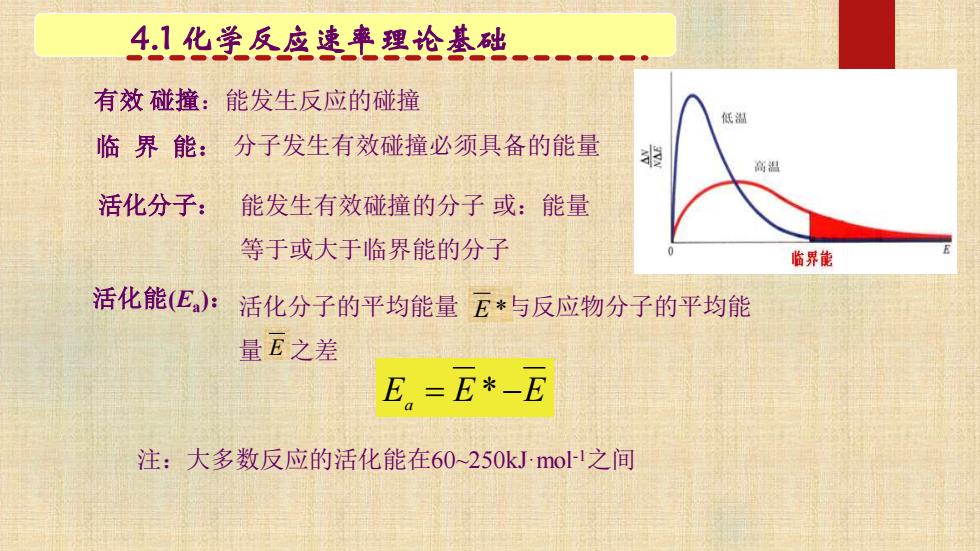
4.1化学反应速率理论基础 有效碰撞:能发生反应的碰撞 低温 临界能:分子发生有效碰撞必须具备的能量 指 高温 活化分子: 能发生有效碰撞的分子或:能量 等于或大于临界能的分子 临界能 活化能(Ea): 活化分子的平均能量E*与反应物分子的平均能 量E之差 E=E*-E 注:大多数反应的活化能在60~250 kJmol-1之间
有效 碰撞:能发生反应的碰撞 分子发生有效碰撞必须具备的能量 能发生有效碰撞的分子 或:能量 等于或大于临界能的分子 活化分子的平均能量 与反应物分子的平均能 量 之差 E * E E a = E*−E 注:大多数反应的活化能在60~250kJ·mol-1之间 4.1 化学反应速率理论基础 临 界 能: 活化分子: 活化能(Ea ):

4.1化学反应速率理论基础 碰撞理论的局限性: X只适用于解释气体分子之间的反应问题 兴不能解释反应的可逆性及副产物问题 兴不能解释反应过程的能量变化
4.1 化学反应速率理论基础 只适用于解释气体分子之间的反应问题 不能解释反应的可逆性及副产物问题 不能解释反应过程的能量变化 碰撞理论的局限性:
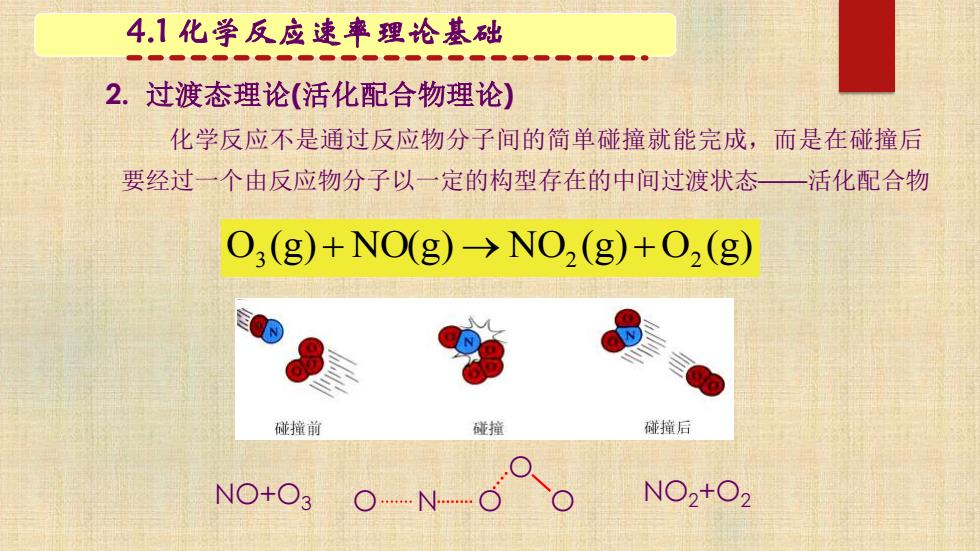
4.1化学反应速率理论基础 2.过渡态理论(活化配合物理论) 化学反应不是通过反应物分子间的简单碰撞就能完成,而是在碰撞后 要经过一个由反应物分子以一定的构型存在的中间过渡状态一 活化配合物 O;(g)+NO(g)->NO2(g)+2(g) 碰撞前 碰撞 碰撞后 NO+O3 N NO2+O2
2. 过渡态理论(活化配合物理论) 化学反应不是通过反应物分子间的简单碰撞就能完成,而是在碰撞后 要经过一个由反应物分子以一定的构型存在的中间过渡状态 4.1 化学反应速率理论基础 ——活化配合物 O (g) NO(g) NO (g) O (g) 3 + → 2 + 2 NO+O3 NO2+O2 O O N O O