
导航 课堂·重难突破 通过实验探究硝酸的氧化性 重难归纳 1.实验探究硝酸的氧化性。 [实验装置] 铜丝(或铁丝) NaOH 硝酸 溶液
导航 一 通过实验探究硝酸的氧化性 重难归纳 1.实验探究硝酸的氧化性。 [实验装置] 课堂·重难突破
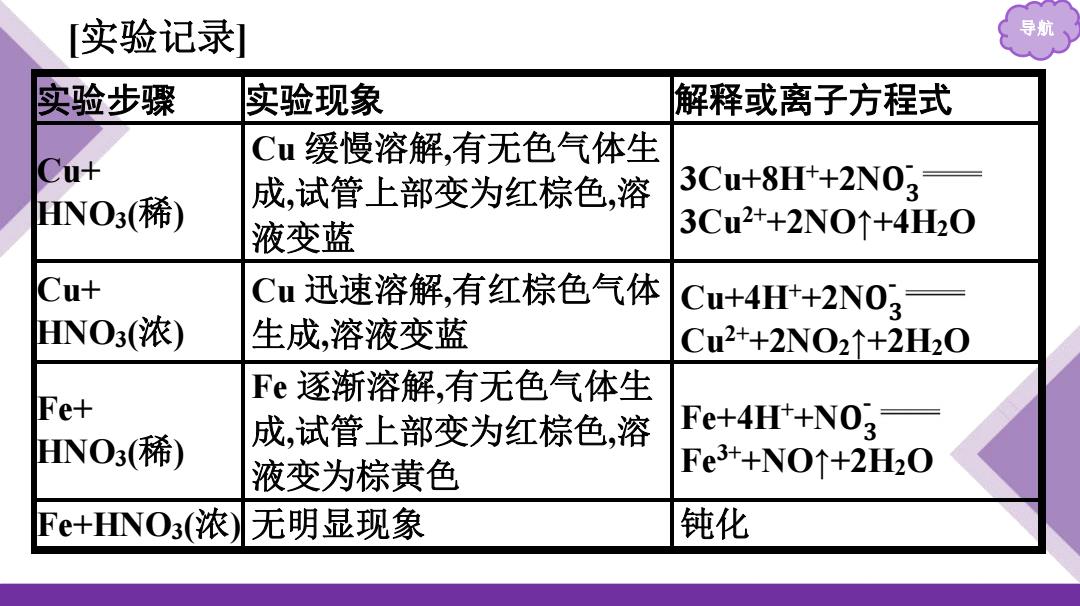
[实验记录] 导航 实验步骤 实验现象 解释或离子方程式 Cu缓慢溶解,有无色气体生 Cu+ 成,试管上部变为红棕色,溶 3Cu+8H++2N0- NO3(稀) 液变蓝 3Cu2++2N0↑+4H20 Cu+ Cu迅速溶解,有红棕色气体 Cu+4H+2N03= HNO3(浓) 生成,溶液变蓝 Cu2+2N02↑+2H2O Fe逐渐溶解,有无色气体生 Fe+ HNOs(稀) 成,试管上部变为红棕色,溶 Fe+4H++NO2 液变为棕黄色 Fe3++NO↑+2H0 Fe+HNO3(浓)无明显现象 钝化
导航 [实验记录] 实验步骤 实验现象 解释或离子方程式 Cu+ HNO3(稀) Cu 缓慢溶解,有无色气体生 成,试管上部变为红棕色,溶 液变蓝 3Cu+8H + +2N 𝐎 𝟑- 3Cu2++2NO↑+4H 2 O Cu+ HNO3(浓) Cu 迅速溶解,有红棕色气体 生成,溶液变蓝 Cu+4H + +2N 𝐎 𝟑- Cu2++2NO 2↑+2H 2 O Fe+ HNO3(稀) Fe 逐渐溶解,有无色气体生 成,试管上部变为红棕色,溶 液变为棕黄色 Fe+4H + +N 𝐎 𝟑- Fe3++NO↑+2H 2 O Fe+HNO3(浓) 无明显现象 钝化

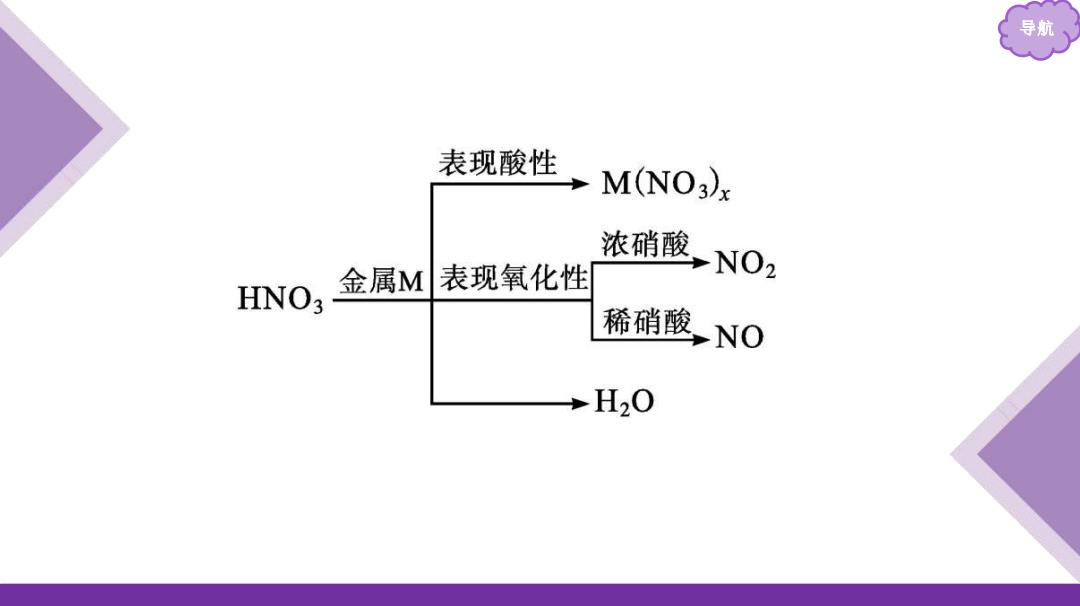
导 2.硝酸的强氧化性。 ⅢO3中+5价的氮元素具有很强的得电子能力。硝酸的浓 度越大,反应温度越高,其氧化性越强。 (1)硝酸与金属的反应。 ①除A、P等少数金属外,硝酸几乎可以氧化所有的金属, 如3Ag+4HN03(稀)=3AgN03+NO↑+2H20; ②活泼金属与硝酸反应不生成H2,硝酸的浓度不同,还原产 物不同;
导航 2.硝酸的强氧化性。 HNO3中+5价的氮元素具有很强的得电子能力。硝酸的浓 度越大,反应温度越高,其氧化性越强。 (1)硝酸与金属的反应。 ①除Au、Pt等少数金属外,硝酸几乎可以氧化所有的金属, 如3Ag+4HNO3 (稀)══3AgNO3+NO↑+2H2O; ②活泼金属与硝酸反应不生成H2 ,硝酸的浓度不同,还原产 物不同;
导航 表现酸性 M(NO) 浓硝酸 NO2 HNO3- 金属M 表现氧化性 稀硝酸 no +H20
导航

(2)硝酸与非金属的反应。 ①反应规律:非金属单质+浓硝酸→最高价氧化物或其含氧 酸+N02↑+H2O; ②实例:C+4HN0浓)△ C02↑+4N02↑+2H20。 (3)硝酸与还原性化合物的反应。 硝酸的强氧化性还表现在可以氧化具有还原性的化合物或 离子,如HI、HBr、SO2、Fe2+、FeO、Br、、S2、S0子等 均能被HNO3氧化
导航 (2)硝酸与非金属的反应。 ①反应规律:非金属单质+浓硝酸→最高价氧化物或其含氧 酸+NO2↑+H2O; ②实例:C+4HNO3(浓) CO2↑+4NO2↑+2H2O。 (3)硝酸与还原性化合物的反应。 硝酸的强氧化性还表现在可以氧化具有还原性的化合物或 离子,如HI、HBr、SO2、Fe2+ 、FeO、Br-、I -、S 2-、 等 均能被HNO3氧化。 S𝐎𝟑 𝟐-