
Que 写出BF4离子的Lewis结构 各原子共提供3+4×731个价电子;离子的一价负电荷表明还应加 一个电子.因此必须在5个原子周围画上16对电子的32个圆点 : :℉:B:f: .F :F: 负电荷属于整个离子而不是个别原子! 上页 下页 节首 节尾
11 各原子共提供3+4×7=31个价电子;离子的一价负电荷表明还应加 一个电子. 因此必须在5个原子周围画上 16 对电子的 32 个圆点 负电荷属于整个离子而不是个别原子! 写出 BF4 Question - 离子的 Lewis 结构. F F B F F F F B F F
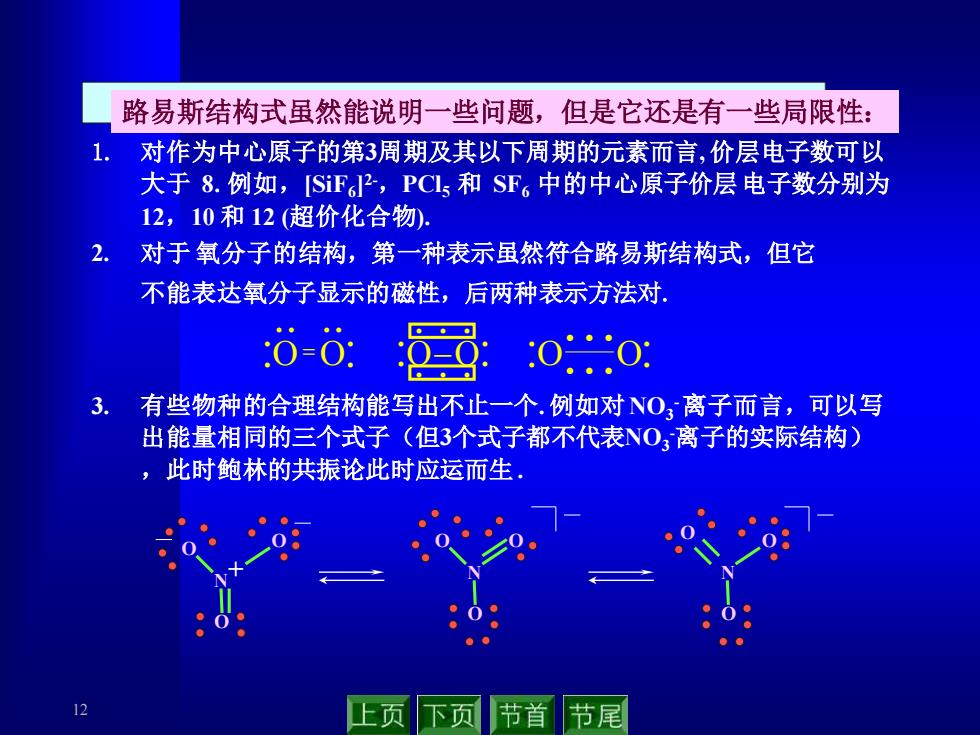
路易斯结构式虽然能说明一些问题,但是它还是有一些局限性: 对作为中心原子的第3周期及其以下周期的元素而言,价层电子数可以 大于8.例如,iF?,PCls和SF。中的中心原子价层电子数分别为 12,10和12(超价化合物). 对于氧分子的结构,第一种表示虽然符合路易斯结构式,但它 不能表达氧分子显示的磁性,后两种表示方法对. 00 000 3 有些物种的合理结构能写出不止一个.例如对NO离子而言,可以写 出能量相同的三个式子(但3个式子都不代表NO离子的实际结构) ,此时鲍林的共振论此时应运而生. 3 上页下页节首 节尾
12 • • • • • • • • O=O • • • • • • • • • • • O O • • • • • • • • • O−O 路易斯结构式虽然能说明一些问题,但是它还是有一些局限性: 1. 对作为中心原子的第3周期及其以下周期的元素而言, 价层电子数可以 大于 8.例如,[SiF6 ] 2-,PCl5 和 SF6 中的中心原子价层电子数分别为 12,10 和 12 (超价化合物). 2. 对于 氧分子的结构,第一种表示虽然符合路易斯结构式,但它 不能表达氧分子显示的磁性,后两种表示方法对. 3. 有些物种的合理结构能写出不止一个. 例如对 NO3 -离子而言,可以写 出能量相同的三个式子(但3个式子都不代表NO3 -离子的实际结构) ,此时鲍林的共振论此时应运而生 . N O O O + N O O O N O O O

2.3用以判断共价分子几何形状的价层电子对 互斥理论(VSEPR for judging t the configuration of the covalence molecular 1940年由Sidgwich N.和Powell H.提出的理论.它在预言多原子分 子形状时取得的成功是令人惊奇的,但理论本身却不过是Lwis思路 的简单延伸。 (I)VSEPR(valence shell electron pair repulsion)基本要点 ●分子或离子的空间构型与中心原子的价层电子对数目有关 VP BP LP 价层成键孤对 ●价层电子对尽可能远离,以使斥力最小 LP-LP>LP-BP>BP-BP 根据VP和LP的数目,可以推测出分子的空间构型 13 上页 页 节首 节尾
13 2.3 用以判断共价分子几何形状的价层电子对 互斥理论 (VSEPR for judging the configuration of the covalence molecular ) 1940年由Sidgwich N. 和 Powell H. 提出的理论. 它在预言多原子分 子形状时取得的成功是令人惊奇的,但理论本身却不过是 Lewis 思路 的简单延伸. ●分子或离子的空间构型与中心原子的价层电子对数目有关 VP = BP + LP 价层 成键 孤对 ●价层电子对尽可能远离, 以使斥力最小 LP-LP> LP-BP > BP-BP ● 根据 VP 和 LP 的数目, 可以推测出分子的空间构型 (1)VSEPR(valence shell electron pair repulsion)基本要点

(2)分子形状的确定方法 。首先先确定中心原子A的价层电子对数VP VP=12A的价电子数+X提供的价电子数士离子电荷数(正)】 原则: A的价电子数=主族序数 配体X:H和卤素每个原子各提供一个价电子,氧与硫不提供价电子 正离子“-”电荷数,负离子“+”电荷 数 例:VPSO子 户26+4X0+2=4 另一种更为简便的方法 VP=BP+LP=与中心原子成键的原子数+ (中心原子价电子数-配位原子未成对电子数之和) 2 例:XeF2 2+8-2×1)/2=5 XeF4 4+8-4×1)/2=6 XeOFa 5+8-1×2-4×1)/2=6 Xe02F24+(8-2X2-2×1)/2=5 上页下页 节首 节尾
14 (2)分子形状的确定方法 ● 首先先确定中心原子A的价层电子对数VP 原则: 配体X: H和卤素每个原子各提供一个价电子, 氧与硫不提供价电子 正离子“-”电荷数, 负离子“+” 电荷 数 例: VP( )= (6+4×0+2)=4 2− SO4 2 1 VP = 1/2[A的价电子数+X提供的价电子数±离子电荷数( )] 负 正 另一种更为简便的方法 VP = BP + LP = 与中心原子成键的原子数+ (中心原子价电子数-配位原子未成对电子数之和) 2 例:XeF2 2+(8-2×1)/2 = 5 XeF4 4+(8-4×1)/2 = 6 XeOF4 5+(8-1×2-4 ×1)/2 = 6 XeO2F2 4+(8-2×2-2 ×1)/2 = 5 A的价电子数= 主族序数
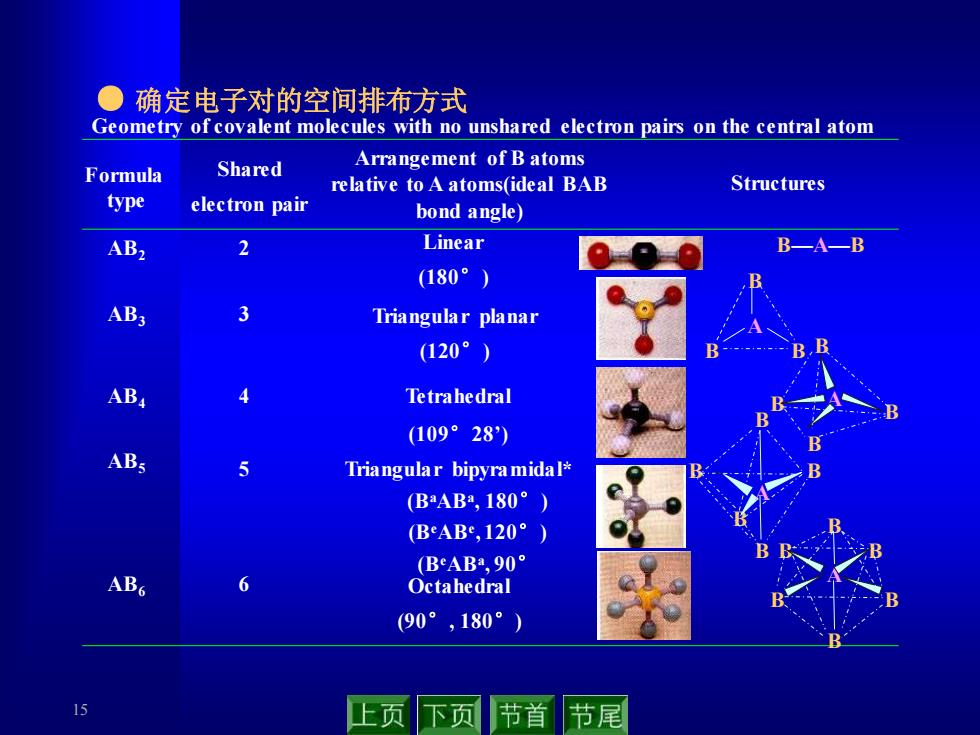
●确定电子对的空间排布方式 Geometry of covalent molecules with no unshared electron pairs on the central atom Shared Arrangement of B atoms Formula relative to A atoms(ideal BAB Structures type electron pair bond angle) AB2 2 Linear BA—B (180°) AB3 3 Triangular planar (120°) B AB4 Tetrahedral (109°28) Triangular bipyramidal* (BAB2,180°) BeAB,120°) (BeAB,90° ABG 6 Octahedral (90°,180°) 15 上页 下页 节首 节尾
15 ● 确定电子对的空间排布方式 Formula type Shared electron pair Arrangement of B atoms relative to A atoms(ideal BAB bond angle) Structures Geometry of covalent molecules with no unshared electron pairs on the central atom 2 Linear (180°) AB B—A—B 2 AB3 3 Triangular planar (120°) A B B B AB4 4 Tetrahedral (109°28’) B A B B B AB5 5 Triangular bipyramidal* (BaABa , 180°) (BeABe , 120°) (BeABa , 90° B B B B B A AB6 6 Octahedral (90°, 180°) A B B B B B B