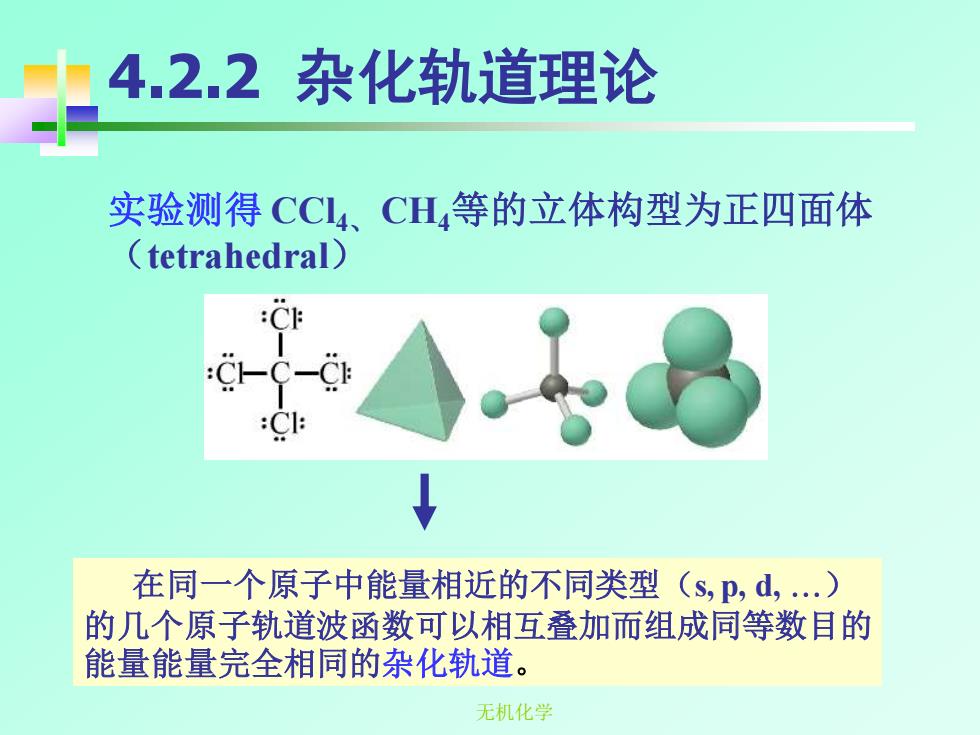
4.2.2杂化轨道理论 实验测得CCL4、CH,等的立体构型为正四面体 (tetrahedral) C-( 1 在同一个原子中能量相近的不同类型(s,p,d,.) 的几个原子轨道波函数可以相互叠加而组成同等数目的 能量能量完全相同的杂化轨道。 无机化学
无机化学 4.2.2 杂化轨道理论 实验测得 CCl4、 CH4等的立体构型为正四面体 (tetrahedral) 在同一个原子中能量相近的不同类型(s, p, d, ) 的几个原子轨道波函数可以相互叠加而组成同等数目的 能量能量完全相同的杂化轨道

杂化轨道的主要类型 sp 直线型 键角180° C02,C2H2 Sp2 平面三角形 键角120° BF3.NO3,C6H6.,C2H4 sp3 正四面体形 键角109°28 CH,H2O,NH3 dsp2 平面四方形 键角90° Ni(CN) dsp3(sp3d) 三角双锥120°和90° PCIs d2sp3(sp3d2)正八面体90° SFo 无机化学
无机化学 杂化轨道的主要类型 sp 直线型 键角180 CO2 , C2H2 sp2 平面三角形 键角120 BF3, NO3 - , C6H6 , C2H4 sp3 正四面体形 键角109 28’’ CH4 , H2O, NH3 dsp2 平面四方形 键角90 Ni(CN)4 2- dsp3 (sp3d) 三角双锥 120和90 PCl5 d 2 sp3 (sp3d 2 ) 正八面体 90 SF6
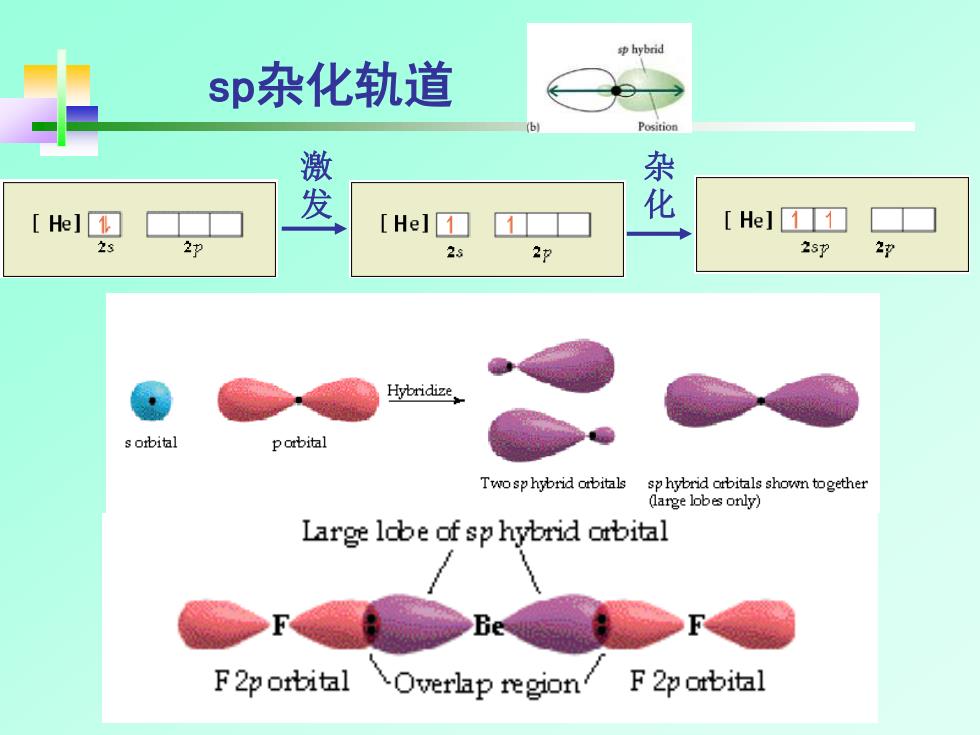
sp hybrid sp杂化轨道 6 Position He] 发 [Hel1 化 He]11 23 22 2s 22 2s7 2p Hybridize s obital pobital Twosp hybrid orbitals sphybrid obitals shown together (large lobes only) Large lobe of sp hybrid orbital F 2porbital Overlap region F 2p obital
无机化学 sp杂化轨道 激 发 杂 化
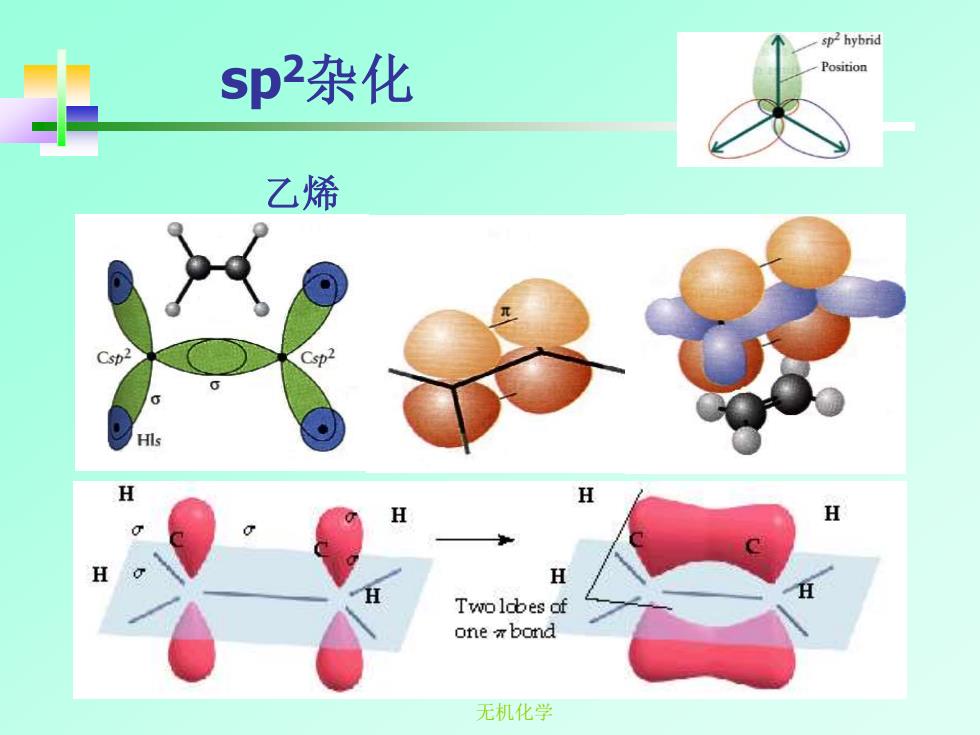
一sp2 hybrid sp2杂化 Position 乙烯 Csp2 H H H Twoldbes of one bond 无机化学
无机化学 sp2杂化 乙烯