
第四章 化学键与分子结构 4.1离子键理论 ■4.2共价键理论 ■4.3金属键理论
第四章 化学键与分子结构 ◼4.1 离子键理论 ◼4.2 共价键理论 ◼4.3 金属键理论
4.1离子键理论 两个原子的交谈 我刚失去 我带正电荷! 一个电子! 真的吗! W N ⊙0 无机化学
无机化学 4.1 离子键理论
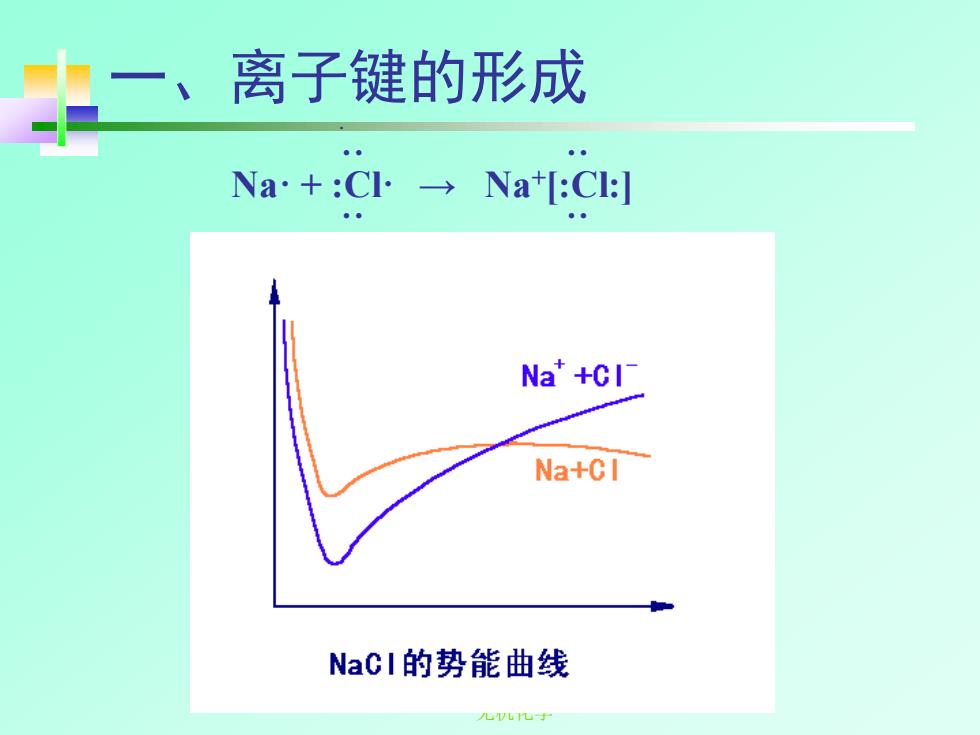
离子键的形成 Na+:C→Na:Cg Na+CI厂 Na+CI NaCI的势能曲线 儿Wbu寸
无机化学 一、离子键的形成 · ·· ·· Na· + :Cl· → Na+ [:Cl:] ·· ··
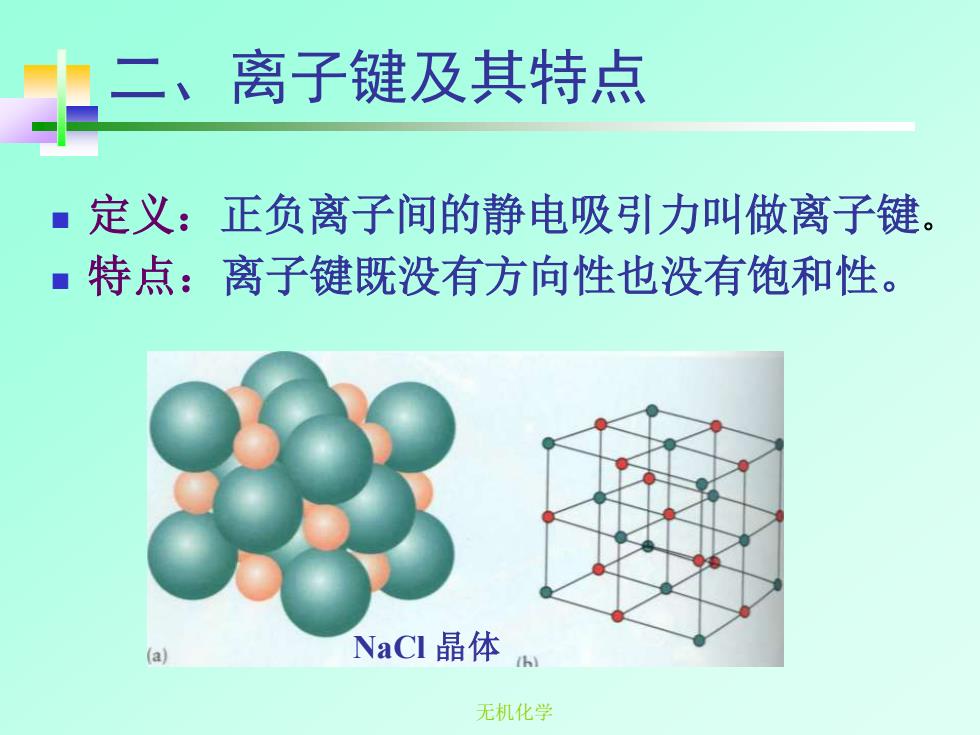
二二、离子键及其特点 定义:正负离子间的静电吸引力叫做离子键。 ■特点:离子键既没有方向性也没有饱和性。 (a) NaCI晶体 h 无机化学
无机化学 二、离子键及其特点 ◼ 定义:正负离子间的静电吸引力叫做离子键。 ◼ 特点:离子键既没有方向性也没有饱和性。 NaCl 晶体

三、 离子键强度与晶格能 晶格能:表示相互远离的气态正离子和负离子 结合成1mol离子晶体时所释放的能量,或1 ol离子晶体解离成自由气态离子时所吸收的 能量。如: Ca2+(g)+2Cl-(g)Cacl2(s) -△H=U=2260.kJ/mol 。离子键强度:用晶格能表示 无机化学
无机化学 三、离子键强度与晶格能 ◼ 晶格能:表示相互远离的气态正离子和负离子 结合成 1 mol 离子晶体时所释放的能量,或1 mol 离子晶体解离成自由气态离子时所吸收的 能量。如: Ca2+ (g) + 2Cl- (g) CaCl2 (s) – H = U = 2260.kJ/mol ◼ 离子键强度:用晶格能表示