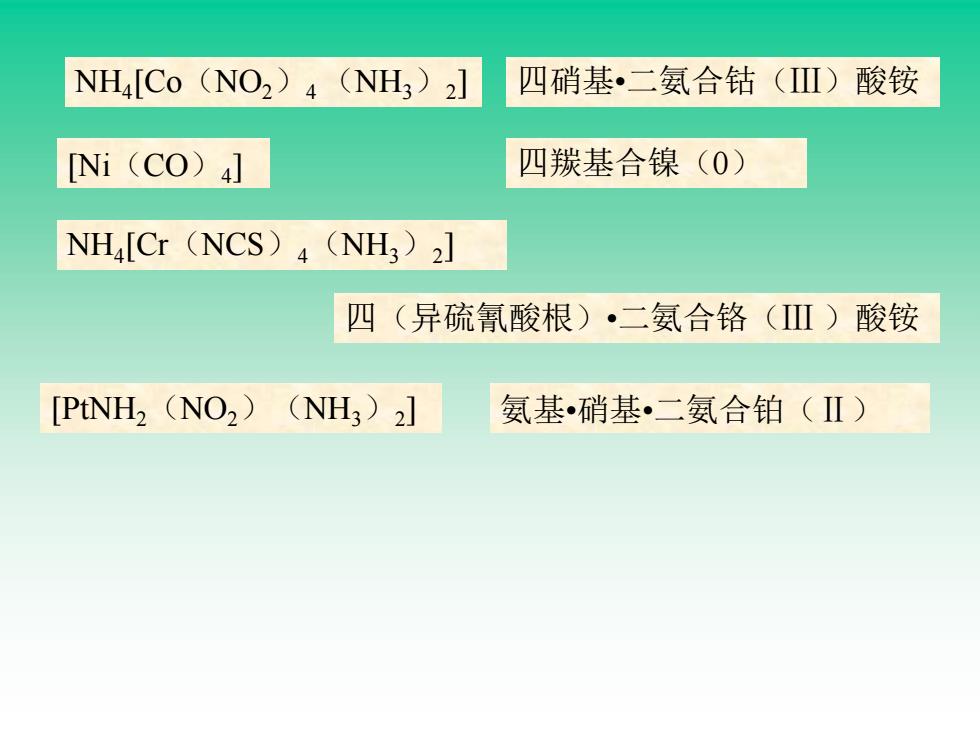
NH4[Co (NO2)4 (NH3)2] 四硝基·二氨合钴(Ⅲ)酸铵 [Ni (CO)4] 四羰基合镍(0) NH4[Cr (NCS)4 (NH3)2] 四(异硫氰酸根)·二氨合铬(Ⅲ)酸铵 [PtNH2 (NO2)(NH3)2] 氨基硝基二氨合铂(Ⅱ)
[PtNH2(NO2)(NH3)2 ] NH4 [Co(NO2)4 (NH3)2 ] 四硝基•二氨合钴(Ⅲ)酸铵 [Ni(CO)4 ] 四羰基合镍(0) NH4 [Cr(NCS)4(NH3)2 ] 四(异硫氰酸根)•二氨合铬(Ⅲ )酸铵 氨基•硝基•二氨合铂(Ⅱ)

三、配合物的屏构现象 具有相同组成的配合物结构却不同的现象称配合 物的异构现象 配合物的异构现象有好多种,这里只介绍键合异构和儿何异构 (一)键合异构 由两可配体使用不同的配位原子引起的异构现象 [CoNO2 (NH3)512+ [CoONO (NH)512+ (二)几何异构 配体在中心原子周围的排布方式不同而引起的异构现象 如PCL2(NH)的顺式和反式
三、配合物的异构现象 具有相同组成的配合物结构却不同的现象称配合 物的异构现象 配合物的异构现象有好多种,这里只介绍键合异构和几何异构 (一)键合异构 由两可配体使用不同的配位原子引起的异构现象 [CoNO2(NH3)5 ] 2+ [CoONO(NH3)5 ] 2+ (二)几何异构 配体在中心原子周围的排布方式不同而引起的异构现象 如[PtCl2(NH3)2 ]的顺式和反式

§9.2配位化合物的化学键理论 一、配位化合物的价键理论 (一)价键理论的基本要点 1.配位原子提供孤对电子,填入中心原子的价电子层 空轨道形成配位键。 2.为了增强成键能力和形成结构匀称的配合物,中心原 子所提供的空轨道首先进行杂化,形成数目相等、能量相同、 具有一定空间伸展方向的杂化轨道,中心原子的杂化轨道与 配位原子的孤对电子轨道在键轴方向重叠成键。 3.配合物的空间构型,取决于中心原子所提供杂化轨道 的数目和类型。 请看下表:
§9.2 配位化合物的化学键理论 一、配位化合物的价键理论 (一)价键理论的基本要点 1.配位原子提供孤对电子,填入中心原子的价电子层 空轨道形成配位键。 2.为了增强成键能力和形成结构匀称的配合物,中心原 子所提供的空轨道首先进行杂化,形成数目相等、能量相同、 具有一定空间伸展方向的杂化轨道,中心原子的杂化轨道与 配位原子的孤对电子轨道在键轴方向重叠成键。 3.配合物的空间构型,取决于中心原子所提供杂化轨道 的数目和类型。 请看下表:
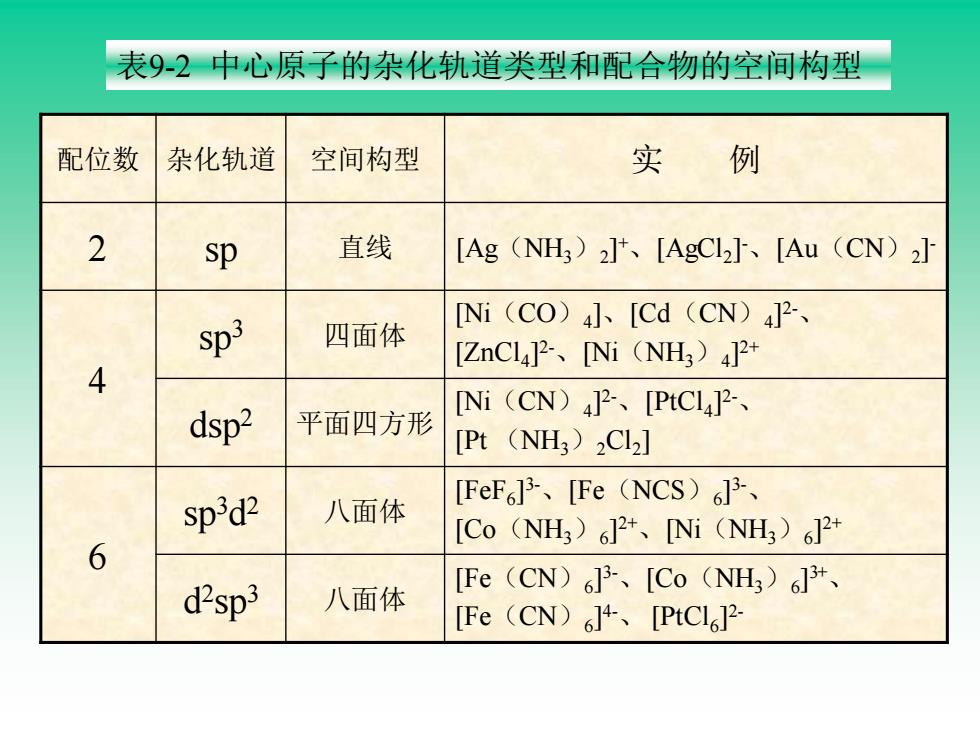
表9-2中心原子的杂化轨道类型和配合物的空间构型 配位数 杂化轨道 空间构型 实例 2 sp 直线 [Ag(NH)2]、[AgCl2]、[Au(CN)2] sp3 [Ni(CO)4]、[Cd(CN)4]2-、 四面体 [ZnCL4]2-、[Ni(NH3)4]2+ 4 dsp2 [Ni(CN)4]2、[PtCl4]2-、 平面四方形 [Pt (NH)2Cl2] spd2 [FeF6J3-、[Fe(NCS)6J3-、 八面体 [Co(NH3)6J2+、Ni(NH3)62+ 6 [Fe(CN)J3-、[Co(NH)6J+、 d2sp3 八面体 [Fe(CN)6J4、[PtC6]2-
配位数 杂化轨道 空间构型 实 例 2 sp 直线 [Ag(NH3)2 ] + 、[AgCl2 ] -、[Au(CN)2 ] - 4 sp3 四面体 [Ni(CO)4 ]、[Cd(CN)4 ] 2-、 [ZnCl4 ] 2-、[Ni(NH3)4 ] 2+ dsp2 平面四方形 [Ni(CN)4 ] 2-、[PtCl4 ] 2-、 [Pt (NH3)2Cl2 ] 6 sp3d 2 八面体 [FeF6 ] 3-、[Fe(NCS)6 ] 3-、 [Co(NH3)6 ] 2+ 、[Ni(NH3)6 ] 2+ d 2 sp3 八面体 [Fe(CN)6 ] 3-、[Co(NH3)6 ] 3+ 、 [Fe(CN)6 ] 4-、 [PtCl6 ] 2- 表9-2 中心原子的杂化轨道类型和配合物的空间构型

(二)外轨配合物和内轨配合物 中心原子全部用最外层价电子空轨道(nS、p、nd) 进行杂化成键,所形成的配合物称为外轨配合物(; 如:中心原子采取sp、sp3、spd2 中心原子用次外层(n-1)d轨道和S、p进行杂化成 键,所形成的配合物称为内轨配合物。 如:中心原子采取dsp或d2sp3
(二)外轨配合物和内轨配合物 中心原子全部用最外层价电子空轨道(ns、np、nd) 进行杂化成键,所形成的配合物称为外轨配合物(; 如:中心原子采取 sp、sp3 、sp3d 2 中心原子用次外层(n-1)d 轨道和ns、np 进行杂化成 键,所形成的配合物称为内轨配合物。 如:中心原子采取 dsp2或d 2 sp3