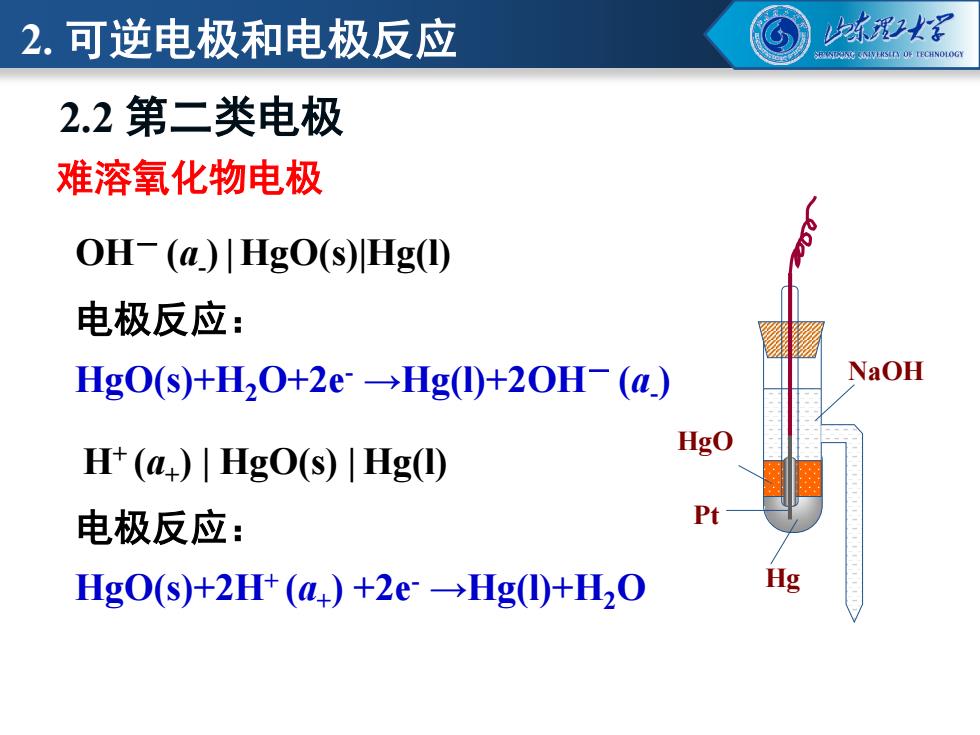
2.可逆电极和电极反应 冰2 aiVK5no乐TECHNOLOG 2.2第二类电极 难溶氧化物电极 OH-(a)川Hg0(s)Hg) 电极反应: HgO(s)+H20+2e→Hg(①+2OH-(a) NaOH HgO H+(a)HgO(s)|Hg(1) 电极反应: Pt HgO(S)+2H+(a)+2e→Hg⑩+H2O Hg
OH- (a- ) | HgO(s)|Hg(l) 难溶氧化物电极 电极反应: HgO(s)+H2O+2e- →Hg(l)+2OH- (a- ) Hg HgO NaOH Pt H+ (a+ ) | HgO(s) | Hg(l) 电极反应: HgO(s)+2H+ (a+ ) +2e- →Hg(l)+H2O 2.2 第二类电极 2. 可逆电极和电极反应
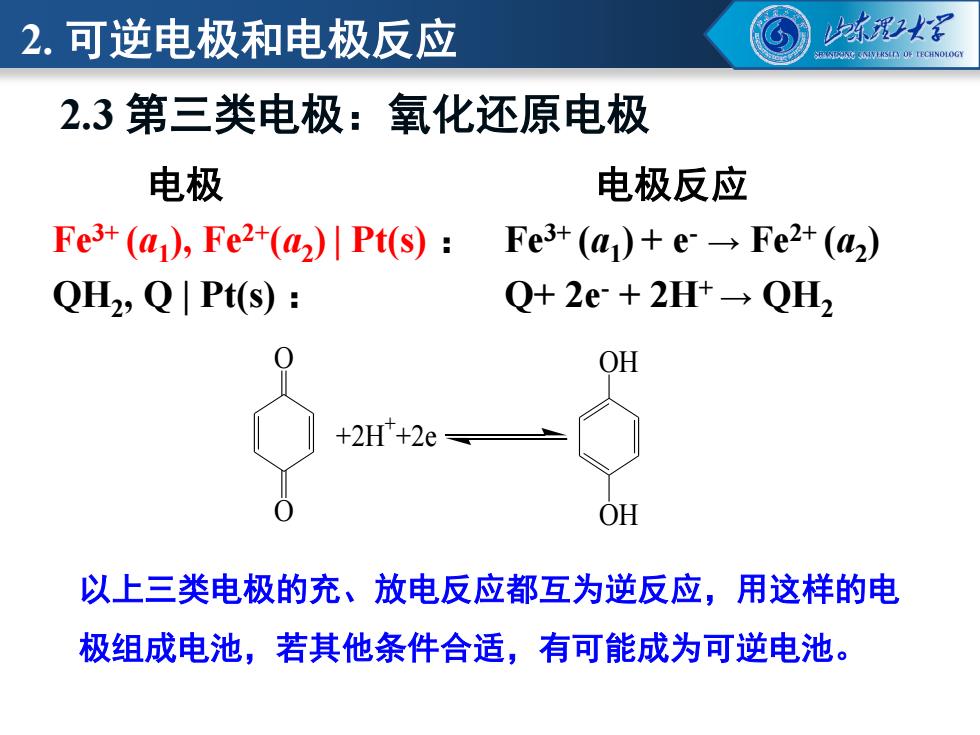
2.可逆电极和电极反应 冰理影军 CNVRSETY OF TECHNOLOGY 2.3第三类电极:氧化还原电极 电极 电极反应 Fe3+(a),Fe2+(a)Pt(s):Fe3+(a)+e-Fe2+(a2) QH2,Q Pt(s): Q+2e+2H+→QH2 OH +2H+2e OH 以上三类电极的充、放电反应都互为逆反应,用这样的电 极组成电池,若其他条件合适,有可能成为可逆电池
2.3 第三类电极:氧化还原电极 电极 电极反应 Fe3+ (a1 ), Fe2+(a2 ) | Pt(s) : Fe3+ (a1 ) + e- → Fe2+ (a2 ) QH2 , Q | Pt(s) : Q+ 2e- + 2H+ → QH2 O O +2H ++2e OH OH 以上三类电极的充、放电反应都互为逆反应,用这样的电 极组成电池,若其他条件合适,有可能成为可逆电池。 2. 可逆电极和电极反应

练习 林影军 OF TECHNOIOG 写出下列电极作为电池正极时的电极反应 (1)SO(ao2川PbS0,(川Pb( (2)H"(aq)|Sb,O(s)|Sb (s) (3)(a)2(s)Pt (4)Sn4+(a1),Sn2+(2)lPt(s)
练习 1 2 - 4 2 - 4 4 SO ( ) SO (a )| PbSO (s)| Pb (s) + 2 3 (2) H (aq) | Sb O (s) | Sb (s) (3) I- (a)|I2 (s)|Pt 写出下列电极作为电池正极时的电极反应 (4) Sn4+ (a1 ), Sn2+(a2 ) | Pt(s)

冰军 NCNVRSETY OF IECHNOLOGY §9.21 电动势的测定 1.对消法测电动势 2.标准电池
§9.2 电动势的测定 1. 对消法测电动势 2. 标准电池

电池的电动势可否用伏特表测量? 林影军 CAVERSETY OF TECHNOIOG 电池的电动势不能用伏特表测量。 >当把伏特计与电池接通后,必须有适当的 电流通过才能使伏特计显示,这样电池中 就发生化学反应,溶液浓度会不断改变; >电池本身也有内阻,因而伏特表上显示的 只是两个电极之间的电势差,而不是电池 的电动势
电池的电动势可否用伏特表测量? 电池的电动势不能用伏特表测量。 ➢ 当把伏特计与电池接通后,必须有适当的 电流通过才能使伏特计显示,这样电池中 就发生化学反应,溶液浓度会不断改变; ➢ 电池本身也有内阻,因而伏特表上显示的 只是两个电极之间的电势差,而不是电池 的电动势