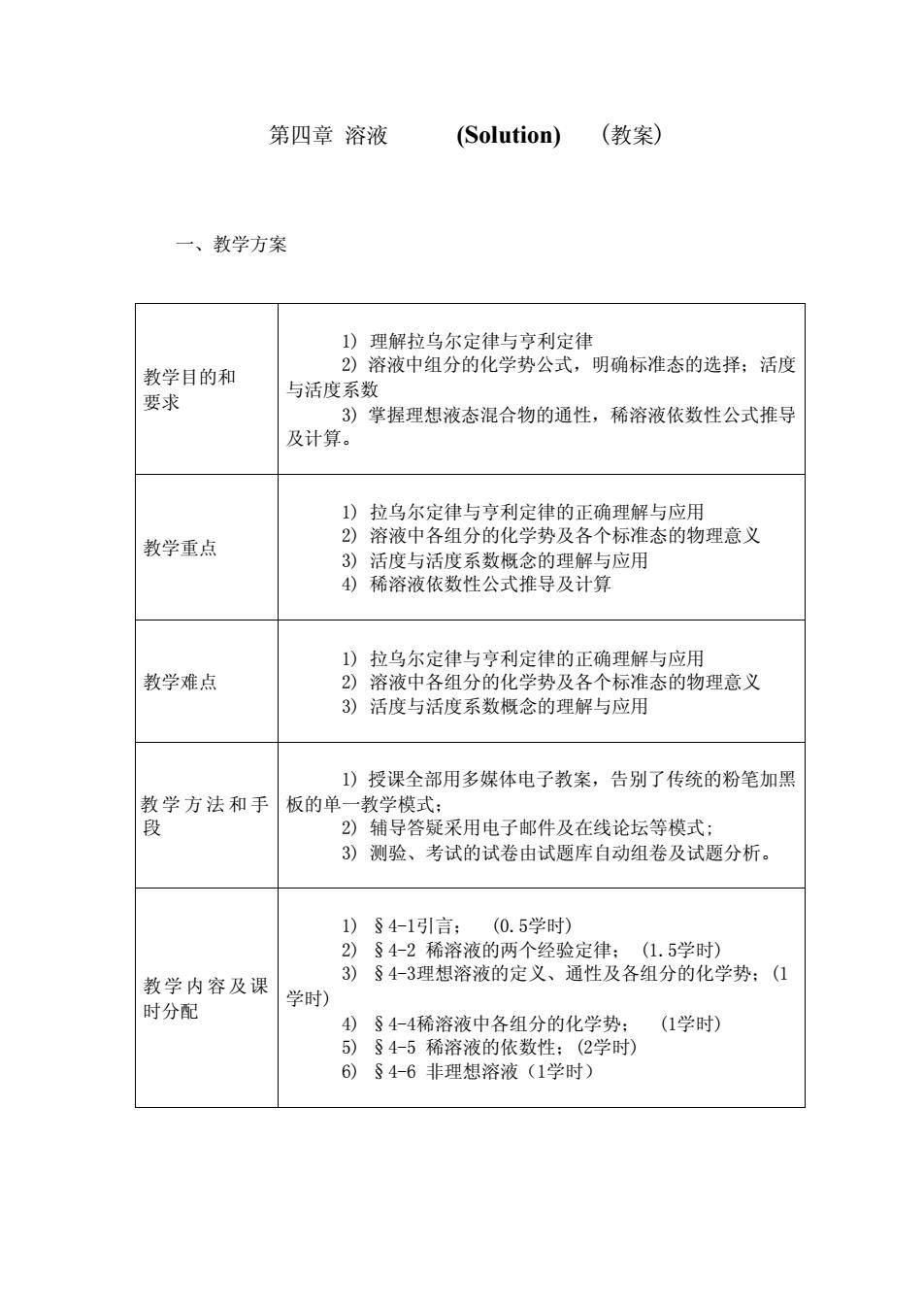
第四章溶液 (Solution))(教案) 一、教学方案 1)理解拉乌尔定律与亨利定律 教学目的和 2)溶液中组分的化学势公式,明确标准态的选择;活度 要 与活度系数 3)掌握理想液态混合物的通性,稀溶液依数性公式推导 及计算 1)拉乌尔定律与亨利定律的正确理解与应用 教学重点 2)溶液中各组分的化学势及各个标准态的物理意义 3)活度与活度系数概念的理解与应用 4稀溶液依数性公式推导及计算 1)拉乌尔定律与立利定律的正确理解与应用 教学难点 2)溶液中各组分的化学势及各个标准态的物理意义 3)活度与活度系数概念的理解与应用 1)授课全部用多媒体电子教案,告别了传统的粉笔加黑 教学方法和手板的单一教学模式 2)辅导答疑采用电子邮件及在线论坛等模式 3)测验、考试的试卷由试题库自动组卷及试题分所。 1)§4-1引言 (0.5学时) 2)§42 容液的两个经验定律:(1.5学时) 教学内容及课 3)§4-3理想溶液的定义、通性及各组分的化学势:(① 时分配 学时) 4)§4-4稀溶液中各组分的化学势: (1学时) 5)S4-5稀溶液的依数性:(2学时) 6)§4-6非理想溶液(1学时)
第四章 溶液 (Solution) (教案) 一、教学方案 教学目的和 要求 1) 理解拉乌尔定律与亨利定律 2) 溶液中组分的化学势公式,明确标准态的选择;活度 与活度系数 3) 掌握理想液态混合物的通性,稀溶液依数性公式推导 及计算。 教学重点 1) 拉乌尔定律与亨利定律的正确理解与应用 2) 溶液中各组分的化学势及各个标准态的物理意义 3) 活度与活度系数概念的理解与应用 4) 稀溶液依数性公式推导及计算 教学难点 1) 拉乌尔定律与亨利定律的正确理解与应用 2) 溶液中各组分的化学势及各个标准态的物理意义 3) 活度与活度系数概念的理解与应用 教 学 方 法 和 手 段 1) 授课全部用多媒体电子教案,告别了传统的粉笔加黑 板的单一教学模式; 2) 辅导答疑采用电子邮件及在线论坛等模式; 3) 测验、考试的试卷由试题库自动组卷及试题分析。 教学内容及课 时分配 1) §4-1引言; (0.5学时) 2) §4-2 稀溶液的两个经验定律; (1.5学时) 3) §4-3理想溶液的定义、通性及各组分的化学势;(1 学时) 4) §4-4稀溶液中各组分的化学势; (1学时) 5) §4-5 稀溶液的依数性;(2学时) 6) §4-6 非理想溶液(1学时)

二、教案内容 §4.1引言 一、概念 通常米讲,溶即溶合,液即液相,两种以上的物质融合成为液相体系被成为溶液。如今, 我们 种种以上的纯物质所组成的均相体系。即以分子级程度相互分散的均相混 合体系称 组成溶 组分均相。溶液以物 购物质以分子分散程度相互混合,所以溶液的性质均匀,任何溶液都是多一 有 根据溶液中溶质的导电性又可分为电解质溶液和非电解质溶液。本章主要讨论液态的非电解 质溶液。关于电解质溶液,以后将专门讨论。 为了方便,我们将溶液中的一种物质叫做溶剂(solvent),通常A表示,而将其它物质叫 做溶质(solute),用B表示。溶质和溶剂只是一种人为的区分,有时两者并无严格界限。对于 气体或固体溶于某液体构成的溶液,习惯上将液体叫做溶剂,而将溶于其中的气体或周体叫 做溶质,如果是两种液体构成的溶液,则称其中量多的液体叫溶剂,量少的液体叫溶质。 二、溶液组成的习惯表示方法 作为由多种物质构成的均相系统 溶液的组成能够在一定范围内变化 成可变的系统。溶液的组成是溶 液系的状函精 成范围宽广,而且溶液的某些性质是随组成的不同而异。溶液组成的表示方法很多,最常用 的有以下四种: 1.物质的量分数(摩尔分数)溶液中物质B的物质的量分数定义为术B 物质B的质量/MB ∑(物质B的质量/MB) (4-1-1) 表示为物质B的物质的量与混合物的物质的量之比。此式中B不仅指溶质,而代表溶液中的任 ∑xB 一物质。显然 =1 2.质量分数物质B的质量分数是指溶液中所含B的质量与溶液的总质量之比:州: 物质B的质量 丁物质B的质量 WB B =1 (4-1-2) B和都是无量纲的量。” 3.溶质B的质量摩尔浓度(mlat)溶质B的质量摩尔浓度是指1Kg溶剂中所溶解的 B的物质的量:m店 ”_物质B的质量 mB_WA MBWA =NAMA (4-1-3) 式中为溶于质量为的溶剂A中的溶质B的物质的量:为溶剂A的摩尔质量,单位为
二、教案内容 §4.1 引 言 一、 概念 通常来讲,溶即溶合,液即液相,两种以上的物质融合成为液相体系被成为溶液。如今, 我们将其扩展重新定义: 凡是由二种或二种以上的纯物质所组成的均相体系,即以分子级程度相互分散的均相混 合体系称为溶液 (solution)。 由于组成溶液的物质以分子分散程度相互混合,所以溶液的性质均匀,任何溶液都是多 组分均相。溶液以物态可分为气态溶液、固态溶液和液态溶液。气体混合物是气态溶液,有 时在一定条件下多种不同的固体(例如Au和Ag)也可构成溶液,这种固态溶液称为固溶体。 根据溶液中溶质的导电性又可分为电解质溶液和非电解质溶液。本章主要讨论液态的非电解 质溶液。关于电解质溶液,以后将专门讨论。 为了方便,我们将溶液中的一种物质叫做溶剂(solvent),通常A表示,而将其它物质叫 做溶质(solute),用B表示。溶质和溶剂只是一种人为的区分,有时两者并无严格界限。对于 气体或固体溶于某液体构成的溶液,习惯上将液体叫做溶剂,而将溶于其中的气体或固体叫 做溶质,如果是两种液体构成的溶液,则称其中量多的液体叫溶剂,量少的液体叫溶质。 二、 溶液组成的习惯表示方法 作为由多种物质构成的均相系统,溶液的组成能够在一定范围内变化。因此,溶液是组 成可变的系统。溶液的组成是溶液系统的状态函数,是描述溶液的重要变量之一。溶液的组 成范围宽广,而且溶液的某些性质是随组成的不同而异。溶液组成的表示方法很多,最常用 的有以下四种: 1. 物质的量分数(摩尔分数) 溶液中物质B的物质的量分数定义为 = = (4-1-1) 表示为物质B的物质的量与混合物的物质的量之比。此式中B不仅指溶质,而代表溶液中的任 一物质。显然 =1 2. 质量分数 物质B的质量分数是指溶液中所含B的质量与溶液的总质量之比: = ; =1 (4-1-2) 和都是无量纲的量。 3. 溶质B的质量摩尔浓度(molaity) 溶质B的质量摩尔浓度是指1Kg溶剂中所溶解的 B的物质的量: = = (4-1-3) 式中为溶于质量为 的溶剂 A中的溶质 B的物质的量 ;为溶剂A的摩尔质量,单位为

K.l”形M,所以质量摩尔浓度的单位为m0lkgm'.对于二组分溶液,与的关系为: mxn 。 MA (4-1-4) 对于极稀的溶液,上式可以简化为 (4-1-5)xmMA 对于极稀的水溶液,有 xB=0.018mB 支,示组的方法。都是以质量为基准,因此成值不会随体积的流有品 A163 4.物质的量浓度(molarity)为每立方米溶液中所含有溶质B的物质的量C。 (4-1-7) 式中V是溶液的体积,单位为m,所以的单位为mol.m xp+(M.-M)c (4-1-8) MACB 对于极稀溶液,=x:P4 式中PA是溶剂的案度 浓度是溶液系统的强度性质,与溶液的量无关,这为同一溶液中各种不同标度的浓度之 Xmg3,B6山. C。 ma0.0177mol/0.9823·M-0.01770.9823*18*10)=1 moI.kg (2)取100g溶液,则其中含B为(4.4/46)mol,溶液体积为(0.1/992)m C=4.4/46/(0.1/992)=948m01.m §4.2稀溶液的两个经验定律 一、拉鸟尔定律(Raoult'slaw) 在大量实验的基础上,1887年R阳oult发现:在一定温度下,稀薄溶液中溶剂的蒸气压等 于纯溶剂的蒸气压乘以溶液中溶剂的物质的量分数,此结论称为Raoult定律,用公式表示为 (42-1)PP4x 式中代表纯溶剂A的蒸气压,代表溶液中溶剂的物质的量分数。P。x 如果溶液中只有A,B两个组分,则+1X产B
Kg.mol -1,所以质量摩尔浓度的单位为mol.kg -1 。对于二组分溶液,与的关系为: = (4-1-4) 对于极稀的溶液,上式可以简化为 = (4-1-5) 对于极稀的水溶液,有 =0.018 (4-1-6) 以上几种表示组成的方法,都是以质量为基准。因此组成值不会随体积的涨缩而有所改 变,与温度无关。 4. 物质的量浓度 (molarity): 为每立方米溶液中所含有溶质B的物质的量 = (4-1-7) 式中V是溶液的体积,单位为m 3 , 所以的单位为mol.m -3 . 对于二组分体系,与其它浓度单位关系 = (4-1-8) 对于极稀溶液,= = 式中 是溶剂的密度。 浓度是溶液系统的强度性质,与溶液的量无关,这为同一溶液中各种不同标度的浓度之 间进行换算提供了方便,只要取合适量的溶液就可进行简捷换算。 例3-1-1 (1)试求=0.0177的乙醇水溶液的质量摩尔浓度,(2)已知乙醇质量分数为0.044 的溶液的密度ρ=992kg.m -3 ,试求此水溶液的. 解:(1)取1mol溶液,则其中含B(即乙醇)和A(即水)分别为0.0177mol和0.9823mol. =0.0177mol/0.9823·M A =0.0177/(0.9823*18*10 -3 )=1mol.kg -1 (2) 取100g溶液,则其中含B为(4.4/46)mol, 溶液体积为(0.1/992)m 3 , =4.4/46/(0.1/992)=948mol.m-3 §4.2 稀溶液的两个经验定律 一、 拉乌尔定律(Raoult’s law) Raoult做了许多实验来测量溶液上方溶剂的蒸气压。将非挥发性溶质B溶于溶剂A中,溶 液上方与之平衡共存的蒸气的压力,即为溶剂气体的压力pA,可以直接由压力计读出。 在大量实验的基础上,1887年Raoult发现:在一定温度下,稀薄溶液中溶剂的蒸气压等 于纯溶剂的蒸气压乘以溶液中溶剂的物质的量分数,此结论称为Raoult定律,用公式表示为 = (4-2-1) 式中代表纯溶剂A的蒸气压,代表溶液中溶剂的物质的量分数。 如果溶液中只有A, B两个组分,则+=1

P.Pi(1-xs) 拉乌尔定律也可表示为:在溶剂中加入溶质后引起的溶剂蒸气压的改变等于纯溶剂的蒸气压 乘以溶质的摩尔分数。P 使用拉乌尔定律必须注意: 1.使用拉乌尔定律计算溶剂的燕气压时,溶剂的摩尔质量应采用其呈气态时的摩尔质最,而 不考虑分子的 但后来人们发现 式中P,是溶液上方溶剂的蒸气分压,因此,R 任何稀薄溶湾由于溶剂中 “旦加人非友性浴质,在溶液的单位表面上溶剂的分子数就有 寸间内从溶液表 的溶剂分子数也将相应减少,因此溶液的平衡蒸 将降低」 3. 律的 若溶液中的任组分在全部浓度范国内都严格服从Ra01t定律,即 4-2-1 PP.xPPs x。 则称为理想溶液。根据3一?-2)可以计算出溶液中的组成物质A和B的蒸气分压,和,再结合 但在有些 年多同 击的 如米和甲苯,甲醇和乙醇等均可近似作为理想洛液为理事系物 定律所得到的蒸气压与组成的直线关系 0.10 B 0.08 P点 0.06 p A d 0.02 。P甲苯 06002 0.40.60.81.0 x(C6H6) 图3-2-1苯-甲苯体系蒸气压与溶液组成图 4.拉乌尔定律一般只使用于非电解质溶液,电解质溶液中的组分因存在电离现象,故拉乌尔 定律不在使用 尽管一般溶液大都不能作为理想溶液处理,但是因为理想溶液服从的规律比较简单,并 且实际上许多溶液在 一定浓度范围内的某 吊衣 现得很 二、亨利定律(Henry'slaw) p= (4-2-3)kx
= = 拉乌尔定律也可表示为:在溶剂中加入溶质后引起的溶剂蒸气压的改变等于纯溶剂的蒸气压 乘以溶质的摩尔分数。 使用拉乌尔定律必须注意: 1. 使用拉乌尔定律计算溶剂的蒸气压时,溶剂的摩尔质量应采用其呈气态时的摩尔质量,而 不考虑分子的缔合等因素。 2. 拉乌尔定律虽然最初是由非挥发性溶质的溶液总结出来的,但后来人们发现,对于挥发性 溶质的溶液也是正确的,此时公式中pA是溶液上方溶剂的蒸气分压,因此,Raoult定律适用于 任何稀薄溶液。由于溶剂中一旦加入非挥发性溶质,在溶液的单位表面上溶剂的分子数就有 所减小,使得在单位时间内从溶液表面逸出的溶剂分子数也将相应减少,因此溶液的平衡蒸 气压也将降低。这就是Raoult定律的微观本质。 3. 若溶液中的任一组分在全部浓度范围内都严格服从Raoult定律,即 = = (4-2-2) 则称为理想溶液。根据(3— 2-2)可以计算出溶液中的组成物质A和B的蒸气分压pA和pB ,再结合 道尔顿分压定律,便可计算出相应的气相组成。严格服从(4— 2-2)的溶液系统是不存在的, 但在有些情况下,象异构体混合物、同位素混合物等可看作理想溶液。此外,许多同系物形 成的溶液,如苯和甲苯,甲醇和乙醇等均可近似作为理想溶液。图4-2-1为典型理想中由Raoult 定律所得到的蒸气压与组成的直线关系。 4. 拉乌尔定律一般只使用于非电解质溶液,电解质溶液中的组分因存在电离现象,故拉乌尔 定律不在使用。 尽管一般溶液大都不能作为理想溶液处理,但是因为理想溶液服从的规律比较简单,并 且实际上许多溶液在一定浓度范围内的某些性质常表现得很象理想溶液。另外,在许多情况 下,只要将理想溶液的公式作一些修正,就能用之于非理想溶液。所以引入非理想溶液的概 念,不仅有理论价值,而且也有实际意义。 二、亨利定律(Henry’s law) 1803年,亨利指出:在一定温度下,当液面上的一种气体与溶液中所溶解的气体达到平 衡时,该气体在溶液中的浓度与其在液面上的平衡压力成正比,这就是亨利定律。 = (4— 2-3)

上式中指所溶解气休在溶液面上的平衡压力,是该气体溶于溶液中的物质的量分数,为以 分数表示溶寝浓暖时的字利宿就,其数值决定于度·压力交溶质和溶剂 对于稀溶液,上式可以简化为 7: p=kx北,nB+na s北=大, 一记速海中所含洛质的物质的民,即等于溶的李东度,所式了 可以写为m上 p= (4-2-4)m 同理,在稀溶液中,若溶质的浓度用物质的量浓度表示,同样可得C。 (42-5)k.ca 太、均称为李利常数,为了使和与有相同的单位,我们将上述公式写做从,人人 州 其中m和。°分别表示标准质量摩尔浓度和标准物质的最浓度,习惯上取m=1mkg c=1000molm,这样和的单位均为Pa。显然以上几种亨利常数相互关联,可以互相换算。k,人 使用利 律时须 式的是该气体在液面上的分压力。对于混合气体在总压不太大的时候,亭利定律能 分别使用于每一种气体,可以近似地认为与其它气体的分压无关。 2.溶质在气相和在溶液中的分子状态必须是相同的,即溶液中溶质的浓度是与气相分子 状态相同的溶解态的浓度。如HC1,在气相为HC1分子,在液相为H,CI,则亨利定律不适 用 3.亨利定律一般只使用于稀溶液,当溶液浓度较高时,亨利定律会产生较大偏差,它是 ·个极限定律,溶液浓度越稀,对亨利定律符合愈好。对气休溶质,升高温度或降低压力, 降低了溶解度,能更好服从亨利定律。 三、两个定律之间的关系 相似点:都是从稀溶液中得出的规律:表示某一物质的平衡蒸气压与该组分在溶液中的浓度 成正比关系。 表4-2-1拉乌尔定律和亨利定律之间的差异 名称 表达式 研究对象 比例常数 代衣意义 拉乌尔定律P4=Px 溶剂 纯溶剂的蒸气压 亨利定律p=k,x 溶质为一实验值,没有明确的物理意义 §4.3理想溶液(ideal solution)的定义、通性及各组分的化学势 理想溶液的引入 的溶 求其共性,舍其差异。这就大大简化了科研中的困难,从而建立一套思想体系,在具体应用
上式中指所溶解气体在溶液面上的平衡压力, 是该气体溶于溶液中的物质的量分数,为以 物质的量分数表示溶液浓度时的亨利常数,其数值决定于温度、压力及溶质和溶剂的性质。 对于稀溶液,上式可以简化为 == 代表1.00kg溶剂中所含溶质的物质的量,即等于溶质的质量摩尔浓度(),所以上式又 可以写为 = (4— 2-4) 同理,在稀溶液中,若溶质的浓度用物质的量浓度表示,同样可得 = (4— 2-5) 、均称为亨利常数,为了使和与有相同的单位,我们将上述公式写做 = = 其中 和 分别表示标准质量摩尔浓度和标准物质的量浓度,习惯上取 =1mol.kg -1 , =1000mol.m -3 ,这样和的单位均为Pa。显然以上几种亨利常数相互关联,可以互相换算。 使用亨利定律时须注意下列几点: 1. 式中的是该气体在液面上的分压力。对于混合气体在总压不太大的时候,亨利定律能 分别使用于每一种气体,可以近似地认为与其它气体的分压无关。 2. 溶质在气相和在溶液中的分子状态必须是相同的,即溶液中溶质的浓度是与气相分子 状态相同的溶解态的浓度。如HCl,在气相为HCl分子,在液相为H + , Cl - ,则亨利定律不适 用。 3. 亨利定律一般只使用于稀溶液,当溶液浓度较高时,亨利定律会产生较大偏差,它是 一个极限定律,溶液浓度越稀,对亨利定律符合愈好。对气体溶质,升高温度或降低压力, 降低了溶解度,能更好服从亨利定律。 三、 两个定律之间的关系 相似点:都是从稀溶液中得出的规律;表示某一物质的平衡蒸气压与该组分在溶液中的浓度 成正比关系。 表4-2-1拉乌尔定律和亨利定律之间的差异 名称 表达式 研究对象 比例常数 代表意义 拉乌尔定律 = 溶剂 纯溶剂的蒸气压 亨利定律 = 溶质 为一实验值,没有明确的物理意义 §4.3 理想溶液(ideal solution)的定义、通性及各组分的化学势 一、 理想溶液的引入 理想溶液(ideal solution),顾名思义,就是理想化的溶液,是实际不存在的溶液。科学 研究的前提往往是要首先建立一个理想化的模型,这个模型是从各种实际的溶液中抽出来的, 求其共性,舍其差异。这就大大简化了科研中的困难,从而建立一套思想体系,在具体应用