
第七章电化学 第一部分电解质溶液(Electrolytic Solution)(教案) 一、教学方案 ①掌握电导、比电导及摩尔电导率的概念,熟悉电导测定的应用: 和影响因素度及离子电导的概念 教学目的和要 ⑤掌握离子强度、平均活度与平均活度系数的概念,稀溶液中电解质平均 活度系数的计算: ⑧了解强电解质溶液离子互吸理论和电导理论。 ①摩尔电导率等概念及计算: 2.教学重点 ②离子独立运动定律: ③平均活度与平均活度系数。 3.教学难点 ①浓度对比电导及摩尔电导率的影响: ②强电解质溶液理论。 ①授课全部用多媒体电子教案,告别了传统的粉笔加黑板的单一教学模 4.教学方法和手 段 教学内容及课 2款药T 铭和迁移 时分配 学@5学助 ⑤572.5强电解质溶液离子互吸理论和电导理论。(1学时) 一、教室内容 §7-l电解质溶液的电导和测定方法(Conductance of electrolyte solution and its 电质的导电 为什么稀盐酸溶液能够导电呢? 物质的量浓度 电导率xS·m C/mol·dnm 273.15K291.15K298.15K 10 6.643 9.820 11.173 1.1192 1.288 0.12270.14114
第七章 电化学 第一部分 电解质溶液(Electrolytic Solution)(教案) 一、教学方案 1. 教学目的和要 求 ① 掌握电导、比电导及摩尔电导率的概念,熟悉电导测定的应用;; ② 掌握离子迁移数的概念和影响因素; ③ 了解离子迁移数的测定方法,离子淌度及离子电导的概念; ④ 掌握离子独立运动定律的原理,并能计算电解质在无限稀释时的摩尔电 导率; ⑤ 掌握离子强度、平均活度与平均活度系数的概念,稀溶液中电解质平均 活度系数的计算; ⑥ 了解强电解质溶液离子互吸理论和电导理论。 2. 教学重点 ① 摩尔电导率等概念及计算; ② 离子独立运动定律; ③ 平均活度与平均活度系数。 3. 教学难点 ① 浓度对比电导及摩尔电导率的影响; ② 强电解质溶液理论。 4. 教学方法和手 段 ① 授课全部用多媒体电子教案,告别了传统的粉笔加黑板的单一教学模 式; ② 辅导答疑采用电子邮件及在线论坛等模式; ③ 测验、考试的试卷由试题库自动组卷及试题分析。 5. 教学内容及课 时分配 ① §7-1电解质溶液的电导和测定方法; (2学时) ② §7-2 离子的电迁移和迁移数; (1.5学时) ③ §7-3 极限迁移数的测定方法,离子淌度与离子电导; (0.5学时) ④ §7-4 电解质溶液的平均活度与平均活度系数; (1学时) ⑤ §7-5 强电解质溶液离子互吸理论和电导理论。 (1学时) 二、教案内容 §7-1电解质溶液的电导和测定方法(Conductance of electrolyte solution and its Mensuration) §7.1.1电解质溶液的导电现象 为什么稀盐酸溶液能够导电呢? 电导率κ/S·m 物质的量浓度 -1 C/mol·dm-3 273.15K 291.15K 298.15K 1.0 0.1 0.01 6.643 0.7154 0.07751 9.820 1.1192 0.1227 11.173 1.2886 0.14114
表7-1-2标准KC1溶液的电导率 01.69 图7-1-2 + 图7-1-1
表7-1-2 标准KCl溶液的电导率 图7-1-2 图7-1-1

电子导体(金属等):电子的定向运动 离子导体(电解质溶液等):离子的定向运动+电极反应电极反应:电极上进行的得失 电子的反应阳极:发生氧化反应的电极(2C1一2e一CL1) 阴极:发生还原反应的电极(2H+2e→且,↑) 电池反应:两个电极反应的总和(2C1+2H→C1,1+H↑)》 离子导体与电子导体的比较: 号的义膜号体导电能力大小的物理量美值为电的版。符号为 G,单位为s(1S=12-1), e ←● ← ← ● ←● 离子在电上的反应 图7-1-5
电子导体(金属等): 电子的定向运动 离子导体(电解质溶液等): 离子的定向运动+电极反应电极反应:电极上进行的得失 电子的反应阳极: 发生氧化反应的电极 (2Cl- - 2e-→ Cl2 ↑) 阴极: 发生还原反应的电极 (2H+ + 2e- → H2 ↑) 电池反应: 两个电极反应的总和 (2Cl- + 2H+ →Cl2 ↑ + H2 ↑) 离子导体与电子导体的比较: §7.1.2. 电导(conductance) 1 电导的物理意义∶量度导体导电能力大小的物理量,其值为电阻的倒数。 符号为 G,单位为S ( 1S=1Ω-1), 图7-1-5
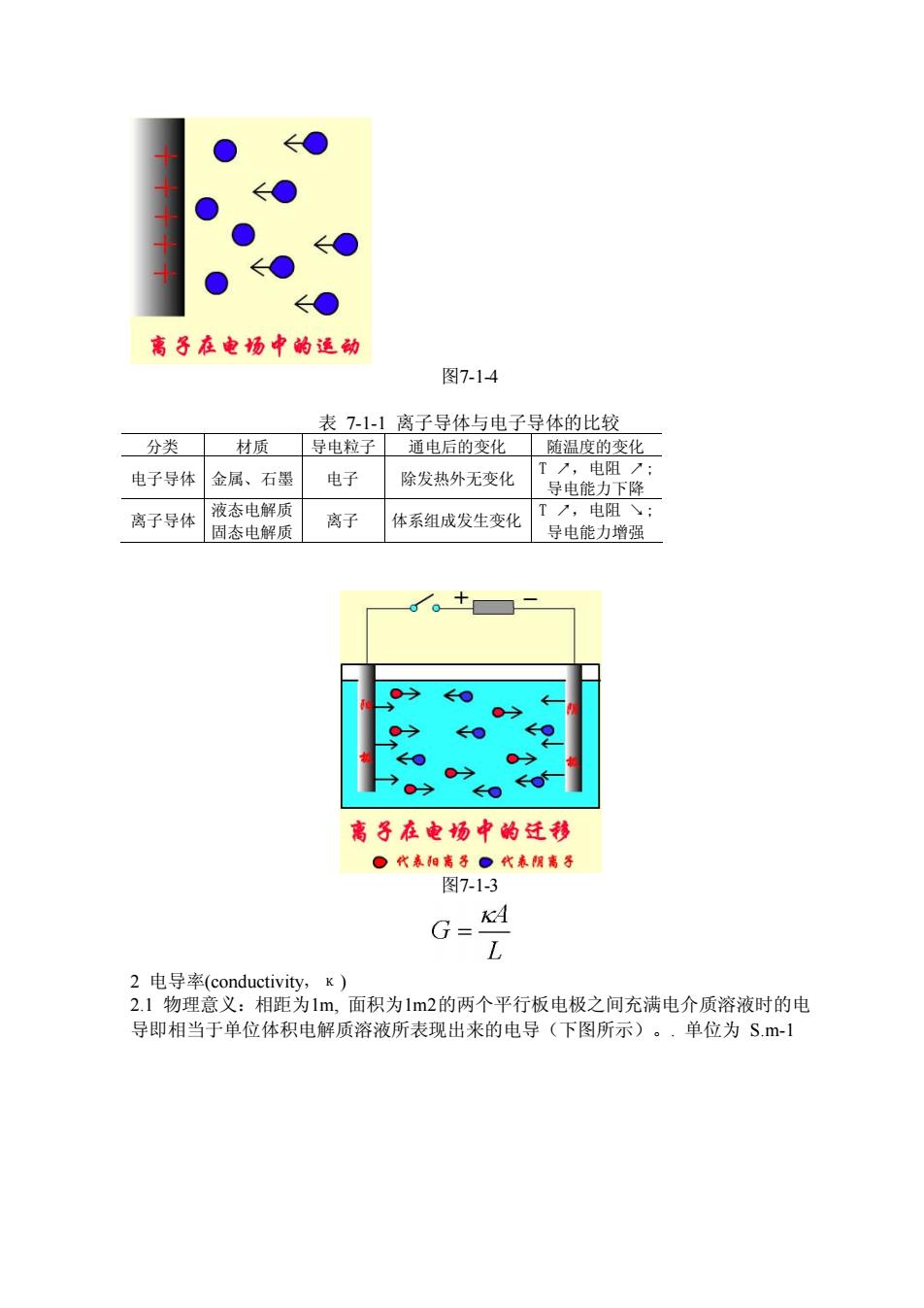
←● 离子在电场中的运动 图7-14 表711离子导体与电子导体的比较 分类材质导电粒子通电后的变化随温度的变化 电子导体金属、石墨电子除发热外无变化 T,电阻: 导电能力下降 高子号体商肉灯体系甜度双生安化甘电产 30→ 07o 离子在电场中的迁移 代泰和离子。代泰离子 图7-1-3 G= L 2由导率(conductivity,.K) 2】物理意义:相距为1m,面积为1m2的两个平行板电极之间充满电介质溶液时的电 导即相当于单位体积电解质溶液所表现出来的电导(下图所示)。·单位为S.m-1
图7-1-4 表 7-1-1 离子导体与电子导体的比较 分类 材质 导电粒子 通电后的变化 随温度的变化 电子导体 金属、石墨 电子 除发热外无变化 T ↗,电阻 ↗; 导电能力下降 离子导体 液态电解质 固态电解质 离子 体系组成发生变化 T ↗,电阻 ↘; 导电能力增强 图7-1-3 2 电导率(conductivity,κ) 2.1 物理意义:相距为1m, 面积为1m2的两个平行板电极之间充满电介质溶液时的电 导即相当于单位体积电解质溶液所表现出来的电导(下图所示)。. 单位为 S.m-1

2.2.影响因素:离子数目、浓度、离子迁移速率、温度及体系本性等因素。 3摩尔电导率(molar conductivity)3.1定义:在相距为单位距离的两个平行电导电极之间, 放置含有1o1电解质的溶液时,溶液所具有的电导称为摩尔电导率(Am),单位为S·m·mol。 个 c V是含有1mol电解质的溶液的体积,单位为m,C是电解质溶液的浓度,单位为 mol·m. 西餐瓷的是取正、负高千各合1m1电药作为电解质的物质的量的基本单元。 A.(NaCI), ).) nB=1mol 图8-1-7 单位立
2.2. 影响因素∶ 离子数目、浓度、离子迁移速率、温度及体系本性等因素。 3.摩尔电导率(molar conductivity)3.1 定义:在相距为单位距离的两个平行电导电极之间, 放置含有1 mol电解质的溶液时,溶液所具有的电导称为摩尔电导率(Λm),单位为S·m 2 ·mol -1 。 V m 是含有1 mol电解质的溶液的体积,单位为m 3,C是电解质溶液的浓度,单位为 mol·m -3。 需要说明的是: ①般情况下,取正、负离子各含1 mol电荷作为电解质的物质的量的基本单元。例如: 图8-1-7