
9.1化学动力学的任务和目的 化学动力学发展简史 1848年 dlnK。△Ue dInk van't Hoff ke 提出: dT RT2 dT RT2 1891年 Arrhenius k=Aexp(- RT 设E,为与T无关的常数 1935年Eyring等提出过渡态理论 1960年交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 9.1 化学动力学的任务和目的 •1848年 van’t Hoff 提出: 2 c a 2 d ln d ln d d K k E T RT T T U R = = b f c k k K = •1891年 Arrhenius a exp( ) E k A RT = − 设 Ea 为与T无关的常数 •1935年 Eyring等提出过渡态理论 •1960年 交叉分子束反应,李远哲等人1986年 获诺贝尔化学奖 化学动力学发展简史
9.2化学反应速率表示法 反应速度与速率 平均速率 瞬时速率 反应进度 转化速率 反应速率 绘制动力学曲线 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 9.2 化学反应速率表示法 反应速度与速率 平均速率 瞬时速率 反应进度 转化速率 反应速率 绘制动力学曲线

反应速度和速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量,无方向性,都是正值。 例如: R→P 速度 dR]<0 dP1,0 dt di 速率 -d[R] d[P] >0 dt dt 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 反应速度和速率 速度 Velocity 是矢量,有方向性。 速率 Rate 是标量 ,无方向性,都是正值。 d[R] d[P] 0 0 d d t t 速度 d[R] d[P] 0 d d t t − 速率 = 例如: R P ⎯⎯→
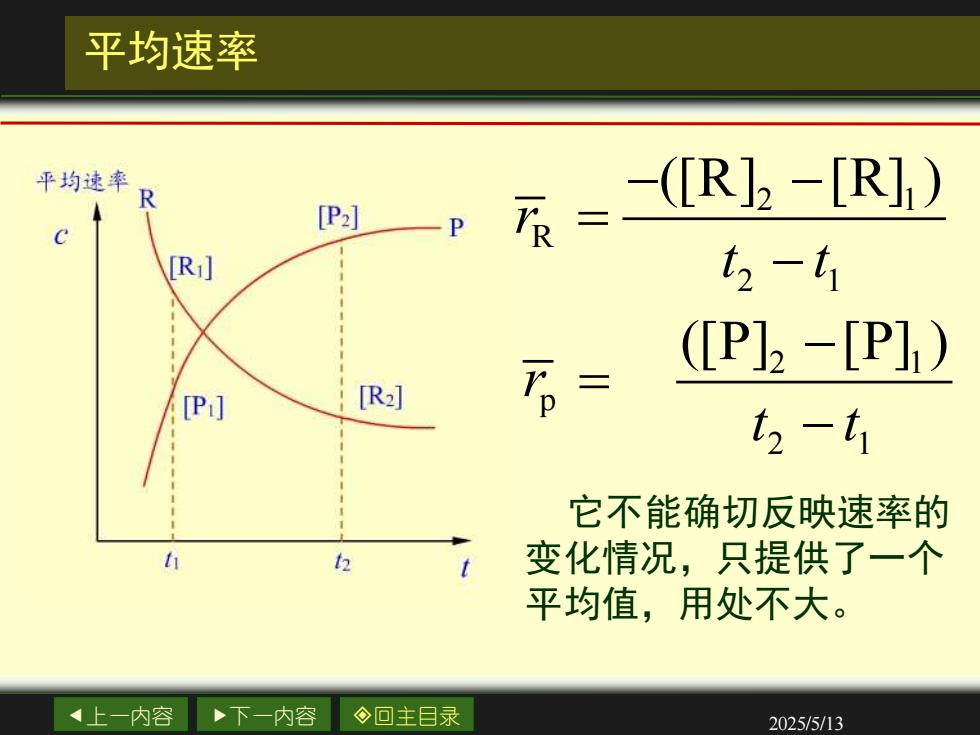
平均速率 平均速率R -(R]2-[R]1) P]一P R= t2-t1 (P]2-[P]) [P:] [R] 万= t2-t1 它不能确切反映速率的 2 变化情况,只提供了一个 平均值,用处不大。 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 平均速率 2 1 R 2 1 ([R] [R] ) r t t − − = − 它不能确切反映速率的 变化情况,只提供了一个 平均值,用处不大。 2 1 p 2 1 ([P] [P] ) r t t − = −
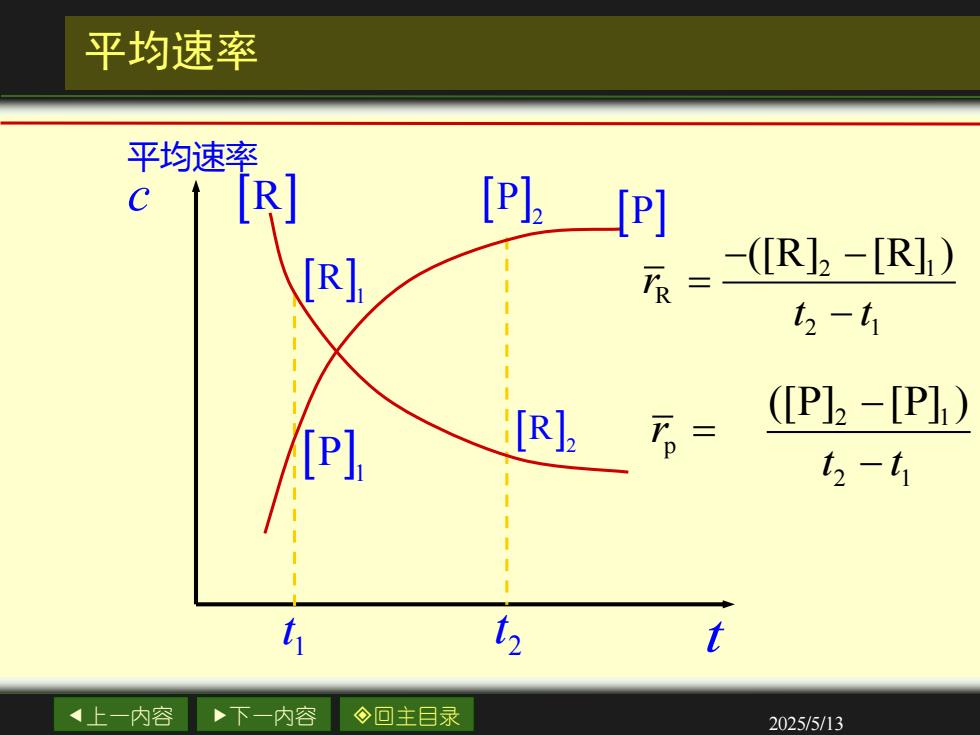
平均速率 平均速率 C [R] [P[P] (IRb-[R)) t2-t1 P] [R]2 万。= (P]2-[P]1) 4-t 1 4上一内容 下一内容 ◇回主目录 2025/5/13
上一内容 下一内容 回主目录 2025/5/13 t c 平均速率 1 t 1 R 1 P 2 t 2 R 2 P P R 平均速率 2 1 R 2 1 ([R] [R] ) r t t − − = − 2 1 p 2 1 ([P] [P] ) r t t − = −