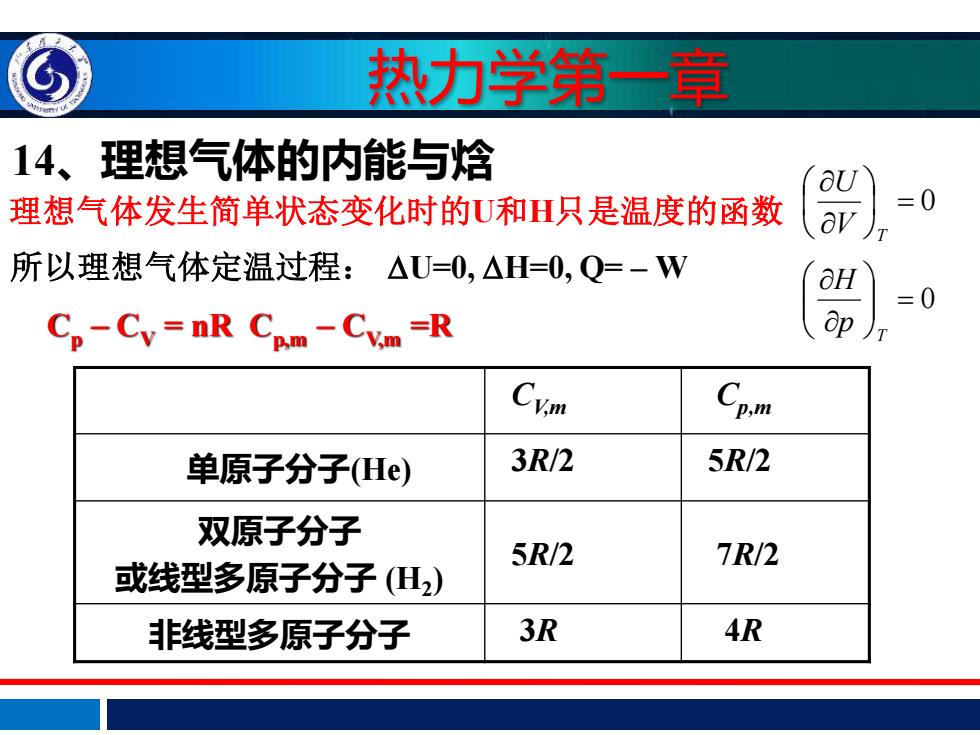
热力学第一章 14、理想气体的内能与焓 aU 理想气体发生简单状态变化时的U和H只是温度的函数 =0 所以理想气体定温过程:△U=0,△H=0,Q=-W =0 Cp-Cy=nR Cpm-Cvm=R Cym Cp.m 单原子分子(He) 3R/2 5R/2 双原子分子 5R/2 7R/2 或线型多原子分子(H2) 非线型多原子分子 3R 4R
热力学第一章 = 0 V T U = 0 T p H 14、理想气体的内能与焓 理想气体发生简单状态变化时的U和H只是温度的函数 所以理想气体定温过程: U=0, H=0, Q= – W Cp − CV = nR Cp,m − CV,m =R CV,m Cp,m 单原子分子(He) 3R/2 5R/2 双原子分子 或线型多原子分子 (H2 ) 5R/2 7R/2 非线型多原子分子 3R 4R

热力学第一章 15、理想气体绝热过程 在绝热过程中,系统与环境间无热的交换,但可以有功的 交换。dUU=δQ+δW=δW (因为8Q=0) Y=Cp/Cy pV”=K 若定容热容与温度无关,则 △U=C(T2-T) 绝热可逆与绝热不可逆过程的终态温度显然是不同的
热力学第一章 15、理想气体绝热过程 在绝热过程中,系统与环境间无热的交换,但可以有功的 交换。 dU Q W = + = 0 W Q (因为 = ) 若定容热容与温度无关,则 2 1 ( ) = U CV T T− 绝热可逆与绝热不可逆过程的终态温度显然是不同的。 1 pV K p / = C CV =

热力学第一章 16、化学反应的热效应 反应进度 def nB-1B.o △nB or ①单位:mol VB VB ②符号:反应物的v为负,产物的v为正;5始终为正 ③飞与反应方程式的写法有关,而与何种物质无关: 反应热:一定温度,只做体积功的条件下,化学反应的热效应。 定容反应热:Qy=△U=v:U(产物)-2y,U(反应物) 定压反应热:Q。=△H=2v:H(产物)-2yH(反应物) 标准摩尔反应热:各物质处于标准态时的反应热。△,Hme(T
热力学第一章 16、化学反应的热效应 反应进度 , 0 def B B B B B n n n − = = def B B d n or d = ① 单位:mol ② 符号:反应物的i为负, 产物的i为正; 始终为正 ③ 与反应方程式的写法有关,而与何种物质无关; 反应热 :一定温度,只做体积功的条件下,化学反应的热效应。 定容反应热:QV = U=i Ui (产物)- j Uj (反应物) 定压反应热:Qp = H=i Hi (产物)- j Hj (反应物) 标准摩尔反应热:各物质处于标准态时的反应热。r Hm (T)

热力学第一章 17、盖斯定律 “一个化学反应不论是一步完成还是分成几步完成,其热效应总 是相同的。 (1)C+02→C02, △,Hme(I) (2)C0+h02(g)→C02 △Hmo(2) (3)C(s)+1/202g)=C0g) △Hmo(3) 反应3等于反应1减反应2,所以 △Hme(3)=△Hme(1)-△,Hme(2)
热力学第一章 17、盖斯定律 “一个化学反应不论是一步完成还是分成几步完成, 其热效应总 是相同的。 (1)C+O2 →CO2 , rHm (1) (2)CO +½O2 (g) →CO2 rHm (2) 反应3等于反应1减反应2,所以 (3)C(s)+1/2O2 (g)=CO(g) rHm (3) - rHm (3)=rHm (1) −rHm (2)

热力学第一章 18、反应热(公H)的计算 A,Hn=YoHmB A,He-EVg4Hmbe A,HR=-∑BYBA.HRB 19、理想气体等压反应热与等容反应热的关系 △H=△U+△n,(RT)Op=O+△n,(RT)
18、反应热(rHm)的计算 r Hm = B B Hm,B r Hm =BfHm,B = − B θ B c m,B θ r Hm H 19、理想气体等压反应热与等容反应热的关系 r r ( ) = + H U n RT g ( ) Q Q n RT p = + V g 热力学第一章