
1.热力学第一定律 热力学第一定律是能量守恒与转化定律在热现 象领域内所具有的特殊形式,说明热力学能、热和 功之间可以相互转化,但总的能量不变。 △U=U2-U1=2+W dU=δ2+δW
1 1. 热力学第一定律 热力学第一定律是能量守恒与转化定律在热现 象领域内所具有的特殊形式,说明热力学能、热和 功之间可以相互转化,但总的能量不变。 U Q W U U 2 1 = − = + dU Q W = +

2.定压热和定容热 (1) dU=8Q,(dV=0,δW=0) △U=2 δ2,=dH(dp=0,δW'=0) △H=Op def H=U+PV
2 2. 定压热和定容热 (1) dU QV = = U QV (d 0 ' 0 V W = = , ) d Q H p = = H Qp (d 0, ' 0) p W = = def H U pV = +

(2) C(T) 6迴 def (简单状态变化,W=0)》 dT G0= aU dT H=e,=∫C,dT (等压,非膨胀功为零的简单状态变化) △U=L,=∫C,dT(等容,非膨张功为零的简单状态变化心 3
3 (2) ( ) def d = Q C T T (简单状态变化, Wf=0 ) ( ) d p p Q C T T = p H T = ( ) d V V Q C T T = V U T = H Q C T = = p pd (等压,非膨胀功为零的简单状态变化) U Q C T = = V Vd (等容,非膨胀功为零的简单状态变化)
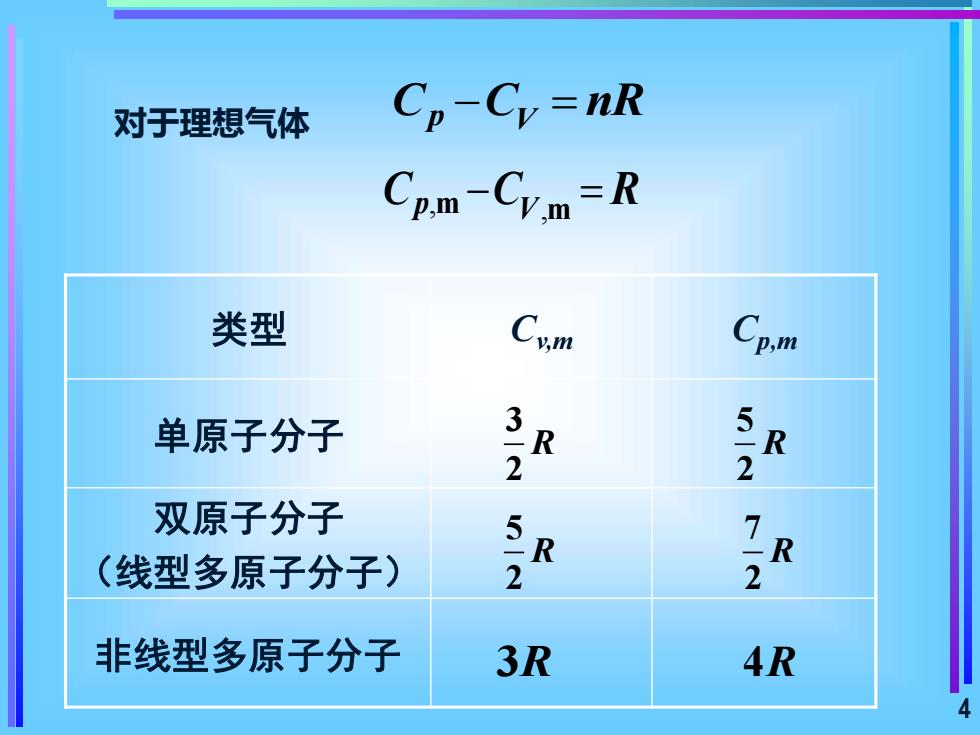
对于理想气体 Cp-Cy=nR Cp.M-Cym=R 类型 Cp 单原子分子 2 2 双原子分子 (线型多原子分子) >R 2 非线型多原子分子 3R 4R 4
4 对于理想气体 C C nR p V − = , p m V,m C C R − = 类型 Cv,m Cp,m 单原子分子 双原子分子 (线型多原子分子) 非线型多原子分子 3 2 R 5 2 R 7 2 R 5 2 R 3R 4R

3.理想气体可逆过程方程 (1)定温可逆过程 pV=K (2)绝热可逆过程 TVr-1 =K1 pV 7=K2 TYpl-Y=K3 式中,K,K2,K,均为常数,y=Cp/Cw 5
5 TV−1 = K1 pV = K2 T p 1−= K3 3. 理想气体可逆过程方程 (1)定温可逆过程 (2)绝热可逆过程 pV = K 式中, K K K 1 2 3 , , 均为常数, / C C p V =