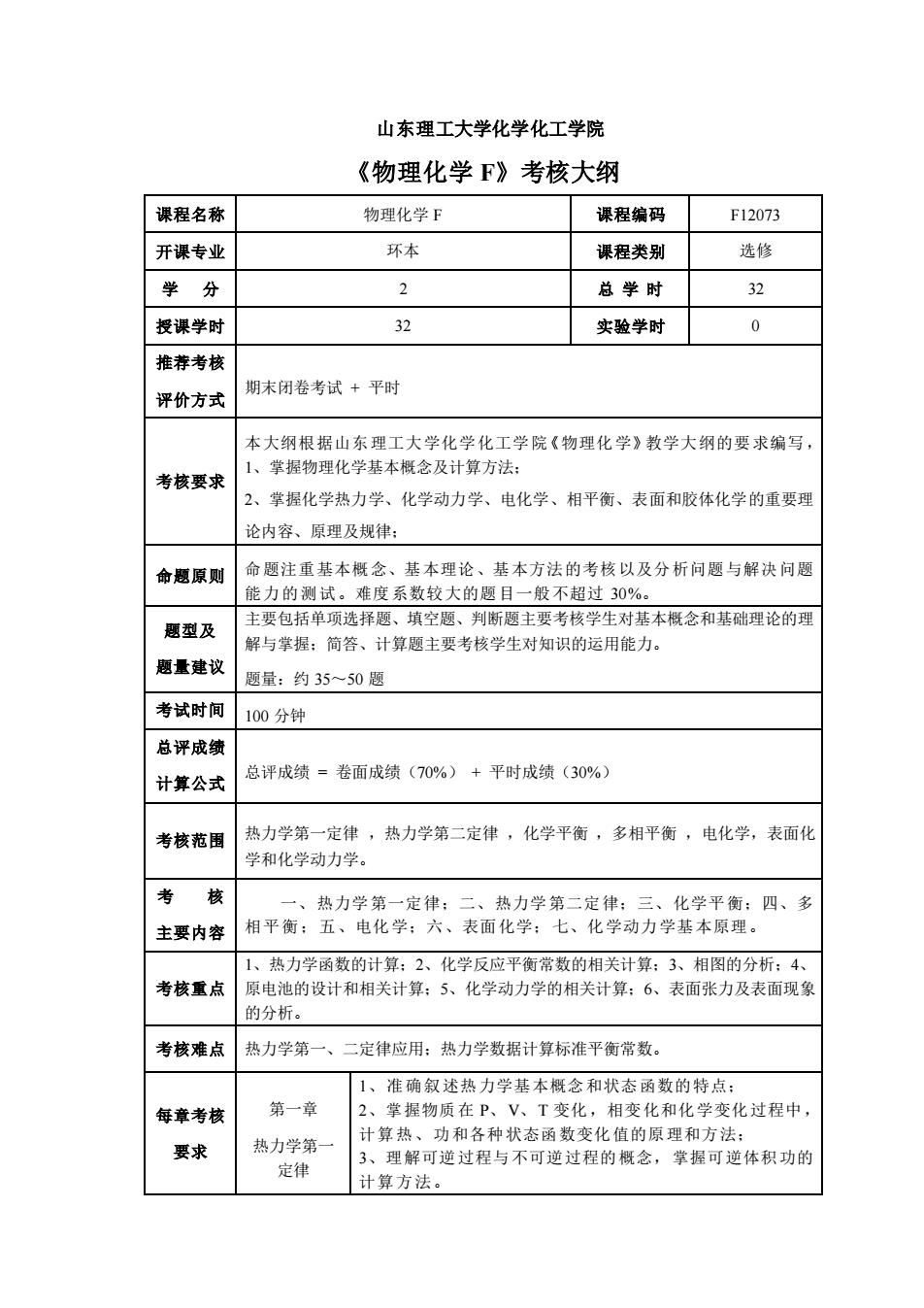
山东理工大学化学化工学院 《物理化学F》考核大纲 课程名称 物理化学F 课程编码 F12073 开课专业 环本 课程类别 选修 学分 2 总学时 32 授课学时 32 实验学时 0 推荐考核 评价方式 期末闭卷考试+平时 本大纲根据山东理工大学化学化工学院《物理化学》教学大纲的要求编写 考核要求 1、掌握物理化学基本概念及计算方法: 2、掌握化学热力学、化学动力学、电化学、相平衡、表面和胶体化学的重要理 论内容、原理及规律: 命题原则 命题注重基本概念、基本理论、基本方法的考核以及分析问题与解决问题 能力的测试。难度系数较大的题目一般不超过30%: 题型及 主要包括单项选择题、填空题、判断题主要考核学生对基本概念和基础理论的理 解与掌握:简答、计算题主要考核学生对知识的运用能力。 题量建议 题量:约35~50题 考试时间100分钟 总评成绩 计算公式 总评成绩=卷面成绩(70%)+平时成绩(30% 考核范围 热力学第一定律,热力学第二定律,化学平衡,多相平衡,电化学,表面化 学和化学动力学。 考核 一、热力学第一定律:二、热力学第二定律:三、化学平衡:四、多 主要内容 相平衡:五、电化学:六、表面化学:七、化学动力学基本原理。 1、热力学函数的计算:2、化学反应平衡常数的相关计算:3、相图的分析:4、 考核重点 原电池的设计和相关计算:5、化学动力学的相关计算:6、表面张力及表面现象 的分析。 考核难点 热力学第一、二定律应用:热力学数据计算标准平衡常数, 1、准确叙述热力学基本概念和状态函数的特点: 每章考核 第一章 2、掌握物质在P、V、T变化,相变化和化学变化过程中 要求 热力学第 计算热、功和各种状态函数变化值的原理和方法: 3、理解可逆过程与不可逆过程的概念,掌握可逆体积功的 定律 计算方法
山东理工大学化学化工学院 《物理化学 F》考核大纲 课程名称 物理化学 F 课程编码 F12073 开课专业 环本 课程类别 选修 学 分 2 总 学 时 32 授课学时 32 实验学时 0 推荐考核 评价方式 期末闭卷考试 + 平时 考核要求 本大纲根据山东理工大学化学化工学院《物理化学》教学大纲的要求编写, 1、掌握物理化学基本概念及计算方法; 2、掌握化学热力学、化学动力学、电化学、相平衡、表面和胶体化学的重要理 论内容、原理及规律; 命题原则 命题注重基本概念、基本理论、基本方法的考核以及分析问题与解决问题 能力的测试。难度系数较大的题目一般不超过 30%。 题型及 题量建议 主要包括单项选择题、填空题、判断题主要考核学生对基本概念和基础理论的理 解与掌握;简答、计算题主要考核学生对知识的运用能力。 题量:约 35~50 题 考试时间 100 分钟 总评成绩 计算公式 总评成绩 = 卷面成绩(70%) + 平时成绩(30%) 考核范围 热力学第一定律 ,热力学第二定律 ,化学平衡 ,多相平衡 ,电化学,表面化 学和化学动力学。 考 核 主要内容 一、热力学第一定律;二、热力学第二定律;三、化学平衡;四、多 相平衡;五、电化学;六、表面化学;七、化学动力学基本原理。 考核重点 1、热力学函数的计算;2、化学反应平衡常数的相关计算;3、相图的分析;4、 原电池的设计和相关计算;5、化学动力学的相关计算;6、表面张力及表面现象 的分析。 考核难点 热力学第一、二定律应用;热力学数据计算标准平衡常数。 每章考核 要求 第一章 热力学第一 定律 1、准确叙述热力学基本概念和状态函数的特点; 2、掌握物质在 P、V、T 变化,相变化和化学变化过程中, 计算热、功和各种状态函数变化值的原理和方法; 3、理解可逆过程与不可逆过程的概念,掌握可逆体积功的 计算方法
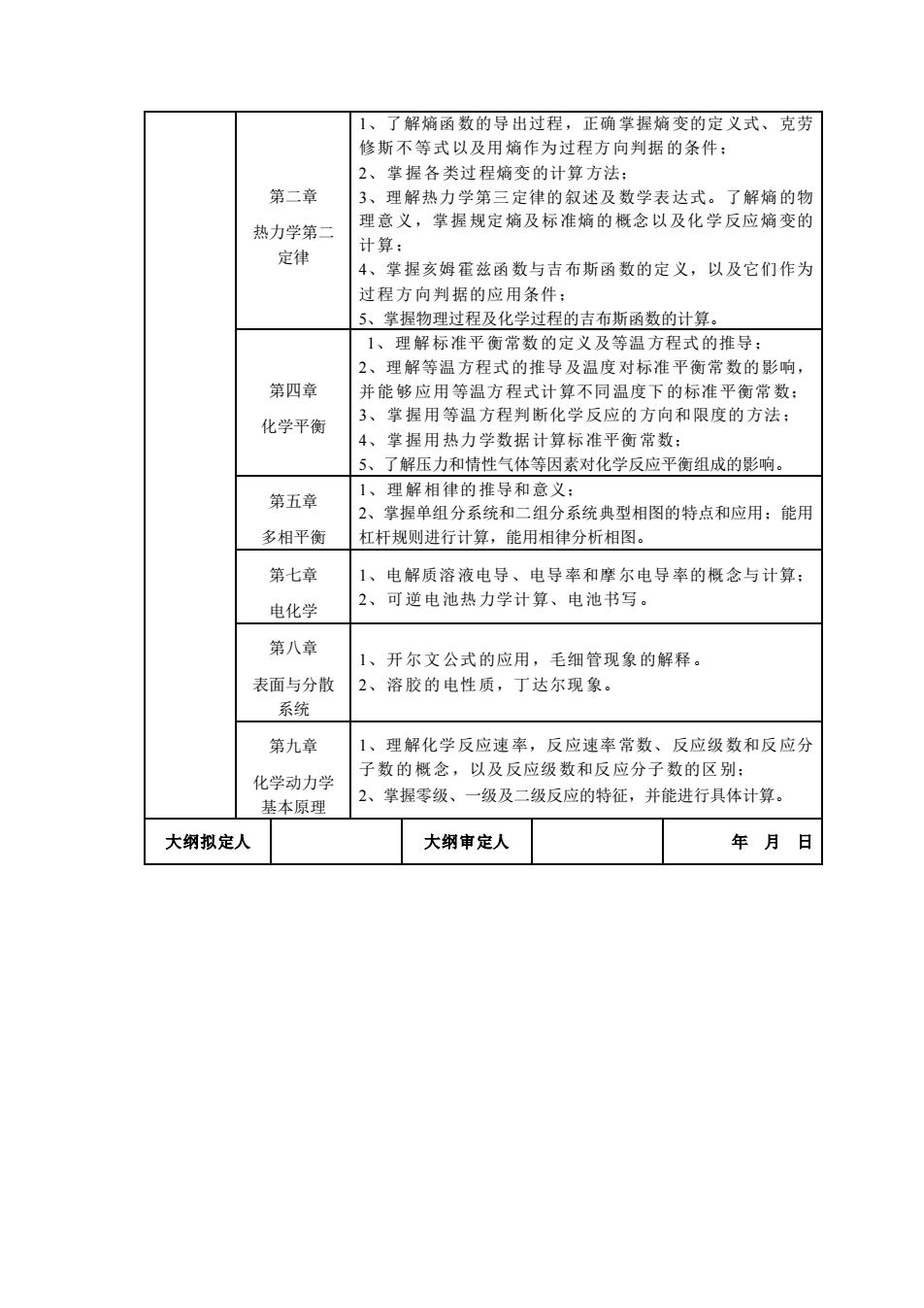
1、了解熵函数的导出过程,正确掌握嫡变的定义式、克劳 修斯不等式以及用熵作为过程方向判据的条件: 掌握各类过程熵变的计算方法。 第二章 理解热力学第三定律的叙述及数学表达式。了解熵的物 热力学第二 理意义,掌握规定熵及标准熵的概念以及化学反应熵变的 计算: 定律 4、掌握交姆霍兹函数与吉布斯函数的定义,以及它们作为 过程方向判据的应用条件 掌握物理过程及化学过程的吉布斯函数的计算 1、理解标准平衡常数的定义及等温方程式的推导: 2、理解等温方程式的推导及温度对标准平衡常数的影响 第四章 并能够应用等温方程式计算不同温度下的标准平衡常数: 化学平衡 掌握用等温方程判断化学反应的方向和限度的方法: 掌握用热力学数据计算标准平衡常数 了解压力和情性气体等因素对化学反应平衡组成的影响。 第五章 、理解相律的推导和意义: 2、掌据单组分系统和二组分系统典型相图的特点和应用:能用 多相平衡 杠杆规则进行计算,能用相律分析相图。 第七章 电解质溶液电导、电导率和摩尔电导率的概念与计算: 电化学 2、 可逆电池热力学计算、电池书写。 第八章 开尔文公式的应用 毛细管现象的解释 表面与分散 溶胶的电性质,丁达尔现象。 系统 第九章 1、理解化学反应速率,反应速率常数、反应级数和反应分 子数的概念,以及反应级数和反应分子数的风别: 化学动力学 掌握零级、一级及二级反应的特征,并能进行具体计算。 基本原理 大纲拟定人 大纲审定人 年月日
第二章 热力学第二 定律 1、了解熵函数的导出过程,正确掌握熵变的定义式、克劳 修斯不等式以及用熵作为过程方向判据的条件; 2、掌握各类过程熵变的计算方法; 3、理解热力学第三定律的叙述及数学表达式。了解熵的物 理意义,掌握规定熵及标准熵的概念以及化学反应熵变的 计算; 4、掌握亥姆霍兹函数与吉布斯函数的定义,以及它们作为 过程方向判据的应用条件; 5、掌握物理过程及化学过程的吉布斯函数的计算。 第四章 化学平衡 1、理解标准平衡常数的定义及等温方程式的推导; 2、理解等温方程式的推导及温度对标准平衡常数的影响, 并能够应用等温方程式计算不同温度下的标准平衡常数; 3、掌握用等温方程判断化学反应的方向和限度的方法; 4、掌握用热力学数据计算标准平衡常数; 5、了解压力和情性气体等因素对化学反应平衡组成的影响。 第五章 多相平衡 1、理解相律的推导和意义; 2、掌握单组分系统和二组分系统典型相图的特点和应用;能用 杠杆规则进行计算,能用相律分析相图。 第七章 电化学 1、电解质溶液电导、电导率和摩尔电导率的概念与计算; 2、可逆电池热力学计算、电池书写。 第八章 表面与分散 系统 1、开尔文公式的应用,毛细管现象的解释。 2、溶胶的电性质,丁达尔现象。 第九章 化学动力学 基本原理 1、理解化学反应速率,反应速率常数、反应级数和反应分 子数的概念,以及反应级数和反应分子数的区别; 2、掌握零级、一级及二级反应的特征,并能进行具体计算。 大纲拟定人 大纲审定人 年 月 日