
实际上大多数A-B键的键能均超过此平均值, 此差值可用以测定A原子和B原子电负性的依据。 如:H-F键的键能为565Kj/mol, 而H-H 155 Kj/mol F-F 436 Kj/mol, 它们的几何平均值为(155×436)=260ki/mol 差值△=565.260=305ki/mol 一系列电负性数据拟合,得方程 XA-XB=0.102△ F的电负性定为4.0,这样H的电负性为 4.0-0.102×(305)=2.2 16
16 实际上大多数A-B键的键能均超过此平均值, 此差值可用以测定A原子和B原子电负性的依据。 如:H-F键的键能为565 Kj/mol, 而H-H 155 Kj/mol F-F 436 Kj/mol, 它们的几何平均值为(155×436)½ = 260kj/mol 差值 ∆ =565 - 260=305 kj/mol 一系列电负性数据拟合,得方程 χA -χB = 0.102 ∆½ F的电负性定为4.0,这样H的电负性为 4.0-0.102×(305) ½ =2.2
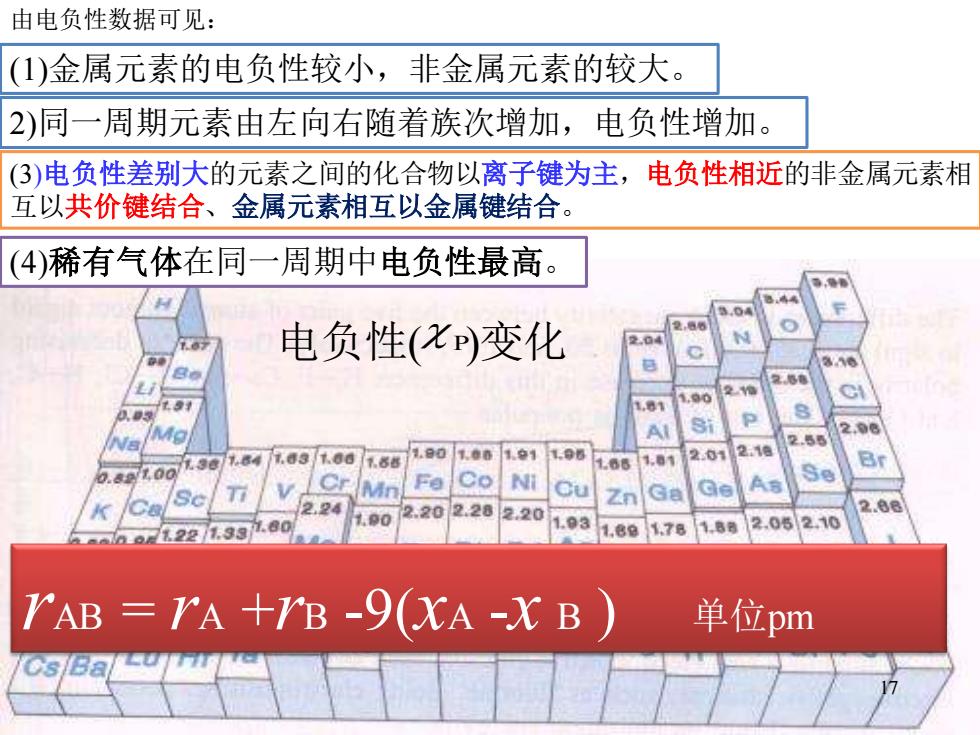
由电负性数据可见: (1)金属元素的电负性较小,非金属元素的较大。 2)同一周期元素由左向右随着族次增加,电负性增加。 (3)电负性差别大的元素之间的化合物以离子键为主,电负性相近的非金属元素相 互以共价键结合、金属元素相互以金属键结合。 (4)稀有气体在同一周期中电负性最高。 电负性(x变化 220 71221.331.80 1.78 210 AB=rA+B-9(XA-XB)单位pm
17 电负性( ) P 变化 由电负性数据可见: (1)金属元素的电负性较小,非金属元素的较大。 2)同一周期元素由左向右随着族次增加,电负性增加。 (3)电负性差别大的元素之间的化合物以离子键为主,电负性相近的非金属元素相 互以共价键结合、金属元素相互以金属键结合。 (4)稀有气体在同一周期中电负性最高。 17 rAB = rA +rB -9(xA -x B ) 单位pm

鲍林(Linus Pauling,1901-) 美国化学家Pauling?对化学最大的贡献是关于化学键本质的研 究及其在物质结构方面的应用。他把量子力学应用于分子结构, 把原子价理论扩展到金属和金属间化合物,并发展了原子核结 构和核裂变过程本质的理论。 由于他在化学键理论研究和应 用研究方面的卓越贡献,荣获 1954年诺贝尔化学奖金。 鲍林对社会问题也十分注视。 他爱好和平,呼吁世界人民注 意大气层核试验所释放的放射 线危险。于1963年10月获得 诺贝尔和平奖
18 鲍林(Linus Pauling,1901-) 美国化学家Pauling对化学最大的贡献是关于化学键本质的研 究及其在物质结构方面的应用。他把量子力学应用于分子结构, 把原子价理论扩展到金属和金属间化合物,并发展了原子核结 构和核裂变过程本质的理论。 由于他在化学键理论研究和应 用研究方面的卓越贡献,荣获 1954年诺贝尔化学奖金 。 鲍林对社会问题也十分注视。 他爱好和平,呼吁世界人民注 意大气层核试验所释放的放射 线危险。于1963年10月获得 诺贝尔和平奖, 18

若干重要的概念: 1、电离能:第一、第二、,电离能(中性原子的失电子行为) 2、电子的结合能:电离能的负值 3、电子的亲合能:气态原子得到一个电子成为一价负离子时 所放出的能量。A(g十e→A(g十E 比电离能小一个数量级,中性原子的得电子行为。 4、原子轨道能:和单电子波函数0:相应的能量E:」 近似等于该轨道上电子的平均电离能的负值, 原子的总能量近似等于各个电子轨道能之和。 5、屏蔽效应和钻穿效应: n相同,不同的轨道的能级:ns<np<nd<nf n、皆不同的轨道能级:基本上是n越大,能级越高 例外:Z≤7,Z>21,3d<4s8≤Z≤20,3d>4s 0251220
2025/2/20 19 若干重要的概念: 1、电离能:第一、第二、.电离能(中性原子的失电子行为) 2、电子的结合能:电离能的负值 4、原子轨道能:和单电子波函数i相应的能量Ei, 近似等于该轨道上电子的平均电离能的负值, 原子的总能量近似等于各个电子轨道能之和。 5、屏蔽效应和钻穿效应: n相同,l不同的轨道的能级:ns<np<nd<nf n、l皆不同的轨道能级:基本上是n越大,能级越高 例外:Z7, Z21, 3d<4s; 8Z20, 3d>4s 3、电子的亲合能:气态原子得到一个电子成为一价负离子时 所放出的能量。A(g)+ e →A- (g)+ E 比电离能小一个数量级,中性原子的得电子行为

6、电子组态:按照轨道能级的高低,将核外电子进行填充, 由,l表示的一种电子排布方式,叫做一种~。 Eg.Fe,1s22s22p63s23p63d64s2Fe[Ar]3d64s2 7、原子的基态:在不违背Paulil原理的条件下,电子优先占据 能级最低的轨道使整个原子的能量最低的状态叫~。 8、电子的互斥能:指同号电荷的库仑排斥能 2025/2/20 20
2025/2/20 20 8、电子的互斥能:指同号电荷的库仑排斥能 6、电子组态:按照轨道能级的高低,将核外电子进行填充, 由n,l表示的一种电子排布方式,叫做一种~。 Eg. Fe,1s22s22p63s23p63d64s2 Fe[Ar]3d64s2 7、原子的基态:在不违背Pauli原理的条件下,电子优先占据 能级最低的轨道使整个原子的能量最低的状态叫~