
第二章原子的结构和性质 2.5元素周期表与元素周期性质 2.5.3原子的电离能 气态原子失去一个电子成为一价气态正离子所需 的最低能量称为原子的第一电离能0),即 A(g)→A+(g)+eI1=△E=E(A+)-E(A) 气态A+失去一个电子成二价气态正离子(A2+)所 需的能量为第二电离能(2),依次类推。 原子的电离能用来衡量一个原子或离子丢失电子 的难易程度,它具有明显的周期性。 11
11 气态原子失去一个电子成为一价气态正离子所需 的最低能量称为原子的第一电离能(I1 ),即 A(g)→A+ (g)+e I1=△E=E(A+ )-E(A) 气态A+失去一个电子成二价气态正离子(A2+ )所 需的能量为第二电离能 (I2 ),依次类推。 2.5.3 原子的电离能 原子的电离能用来衡量一个原子或离子丢失电子 的难易程度,它具有明显的周期性。 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 11
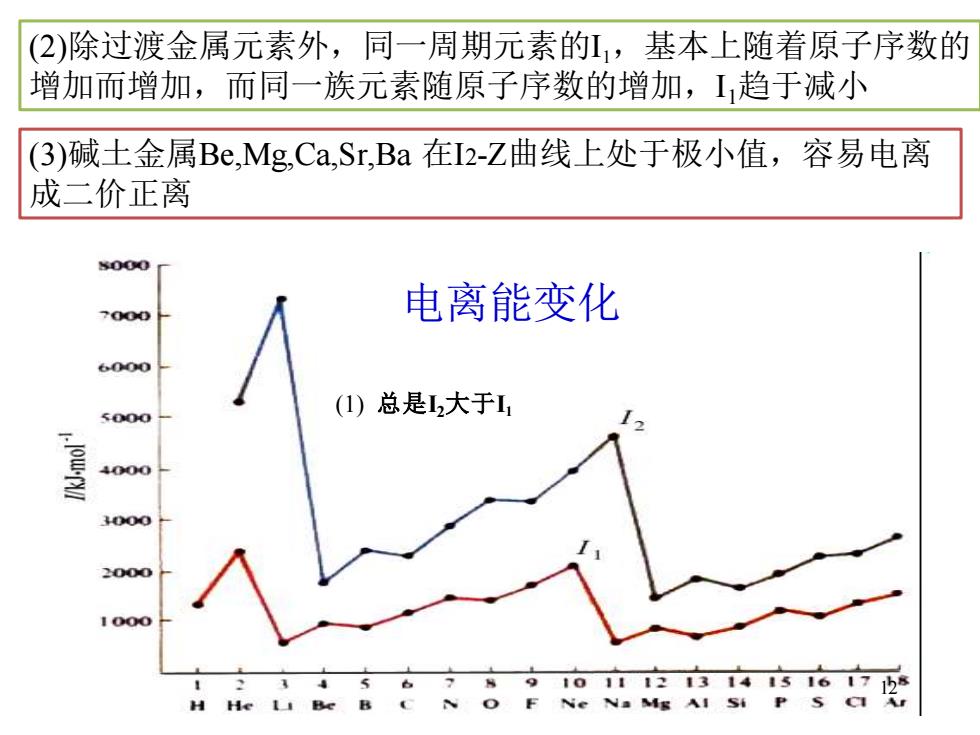
(2)除过渡金属元素外,同一周期元素的,基本上随着原子序数的 增加而增加,而同一族元素随原子序数的增加,I趋于减小 (3)碱土金属Be,MgCa,Sr,Ba在I2-Z曲线上处于极小值,容易电离 成二价正离 000 电离能变化 6000 (1)总是大于I1 5000 4000 3000 2000 1000 91011121314151617h8 H He Ne Na Mg Al Si P S CI Ar
12 电离能变化 (1) 总是I2大于I1 (3)碱土金属Be,Mg,Ca,Sr,Ba 在I2-Z曲线上处于极小值,容易电离 成二价正离 (2)除过渡金属元素外,同一周期元素的I1,基本上随着原子序数的 增加而增加,而同一族元素随原子序数的增加,I1趋于减小 12
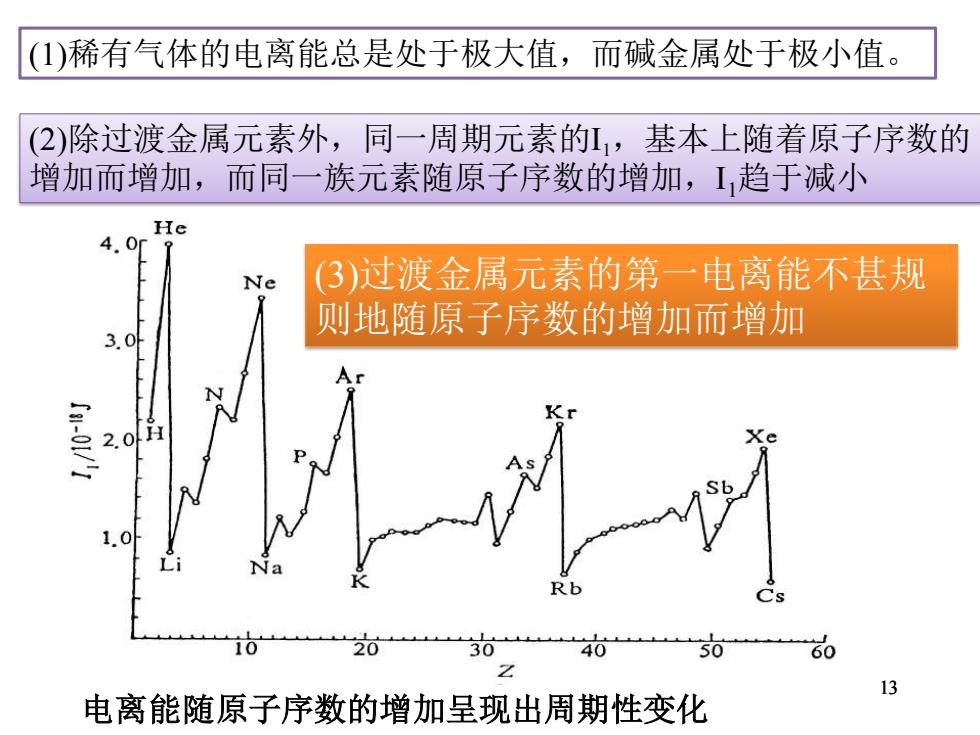
(1)稀有气体的电离能总是处于极大值,而碱金属处于极小值。 (2)除过渡金属元素外,同一周期元素的L,基本上随着原子序数的 增加而增加,而同一族元素随原子序数的增加,I,趋于减小 He 4.0r Ne (3)过渡金属元素的第一电离能不甚规 则地随原子序数的增加而增加 3.0 2.0H 1.0 20 30 50 60 13 电离能随原子序数的增加呈现出周期性变化
13 电离能随原子序数的增加呈现出周期性变化 (1)稀有气体的电离能总是处于极大值,而碱金属处于极小值。 (2)除过渡金属元素外,同一周期元素的I1,基本上随着原子序数的 增加而增加,而同一族元素随原子序数的增加,I1趋于减小 (3)过渡金属元素的第一电离能不甚规 则地随原子序数的增加而增加 13
第二章原子的结构和性质 2.5元素周期表与元素周期性质 2.5.4电子亲和能 定义:气态原子获得一个电子成为一价负离子时所放 出的能量。即: A(g)+e→A(g)+Y 电子亲和能的大小涉及()核的吸引和()核外电荷相斥 两因素。 像电离能一样,电子亲和能也有第一、第二.之分,正值表示放出 能量,负值表示吸收能量。 周期表中,非金属原子的电子亲和能越大,则表示该原子生成负离子的 倾向越大。电子亲和能的周期变化规律与电离能的规律基本相同。如果元素 具有高电离能,则它也倾向于具有高电子亲和势能
14 像电离能一样,电子亲和能也有第一、第二.之分,正值表示放出 能量,负值表示吸收能量。 周期表中,非金属原子的电子亲和能越大,则表示该原子生成负离子的 倾向越大。电子亲和能的周期变化规律与电离能的规律基本相同。如果元素 具有高电离能,则它也倾向于具有高电子亲和势能。 定义:气态原子获得一个电子成为一价负离子时所放 出的能量。即: A(g)+e → A- (g)+Y 电子亲和能的大小涉及(i)核的吸引和(ii)核外电荷相斥 两因素。 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 2.5.4 电子亲和能 14

第二章原子的结构和性质 2.5元素周期表与元素周期性质2.5.5电负性 电负性”由Pauling提出,用以度量原子对成键电 子吸引能力的相对大小。 Pauling的电负性标度Xp是用两元素形成化合物时的生 成焓的数值来计算的。 他认为,若A和B两个原子的电负性相同,A一B键的 键能应为A一A键和B—B键键能的几何平均值。 15
15 “电负性”由Pauling提出,用以度量原子对成键电 子吸引能力的相对大小。 第二章 原子的结构和性质 2.5元素周期表与元素周期性质 2.5.5 电负性 Pauling的电负性标度Xp是用两元素形成化合物时的生 成焓的数值来计算的。 他认为,若A和B两个原子的电负性相同,A—B键的 键能应为A—A键和B—B键键能的几何平均值。 15