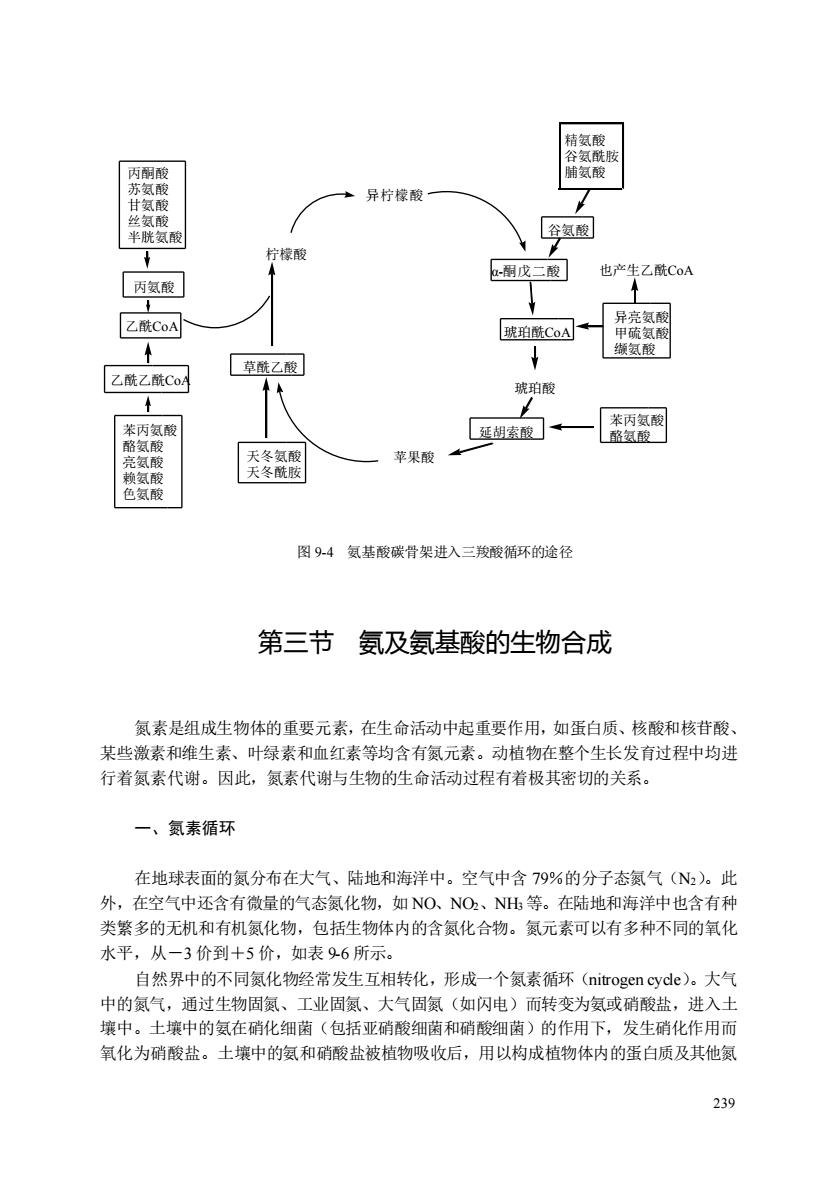
陆氨酸 +异柠檬酸 谷氨酸 柠檬酸 -胡戊二酸」 也产生乙酰CoA 丙氨酸 乙酰CoA 琥珀酰CoA 乙酰乙酰CoA 草酰乙酸 琥珀酸 延胡索酸】← 燕两氨酮 天冬 苹果酸 图94氨基酸碳骨架进入三羧酸循环的途径 第三节氨及氨基酸的生物合成 氯素是组成生物体的重要元素,在生命活动中起重要作用,如蛋白质、核酸和核苷酸 某些激素和维生素、叶绿素和血红素等均含有氮元素。动植物在整个生长发育过程中均进 行着氮素代谢。因此,氮素代谢与生物的生命活动过程有着极其密切的关系, 一、氨素循环 在地球表面的氨分布在大气、陆地和海洋中。空气中含79%的分子态氮气(N)。此 外,在空气中还含有微量的气态氨化物,如NO.、NO2、NH等。在陆地和海洋中也含有种 类繁多的无机和有机氮化物,包括生物体内的含氮化合物。氮元素可以有多种不同的氧化 水平,从一3价到+5价,如表96所示。 自然界中的不同氮化物经常发生互相转化,形成一个氮素循环(nitrogencyde)。大气 中的氮气,通过生物固氮、工业固氮、大气固氨(如闪电)而转变为氨或硝酸盐,进入土 壤中。土壤中的氨在硝化细菌(包括亚硝酸细菌和硝酸细菌)的作用下,发生硝化作用而 氧化为硝酸盐。土壤中的氨和硝酸盐被植物吸收后,用以构成植物体内的蛋白质及其他氮 239
239 琥珀酰CoA 琥珀酸 延胡索酸 苹果酸 草酰乙酸 柠檬酸 α-酮戊二酸 异柠檬酸 谷氨酸 精氨酸 谷氨酰胺 脯氨酸 异亮氨酸 甲硫氨酸 缬氨酸 也产生乙酰CoA 苯丙氨酸 酪氨酸 天冬氨酸 天冬酰胺 苯丙氨酸 酪氨酸 亮氨酸 赖氨酸 色氨酸 乙酰CoA 乙酰乙酰CoA 丙氨酸 丙酮酸 苏氨酸 甘氨酸 丝氨酸 半胱氨酸 图 9-4 氨基酸碳骨架进入三羧酸循环的途径 第三节 氨及氨基酸的生物合成 氮素是组成生物体的重要元素,在生命活动中起重要作用,如蛋白质、核酸和核苷酸、 某些激素和维生素、叶绿素和血红素等均含有氮元素。动植物在整个生长发育过程中均进 行着氮素代谢。因此,氮素代谢与生物的生命活动过程有着极其密切的关系。 一、氮素循环 在地球表面的氮分布在大气、陆地和海洋中。空气中含 79%的分子态氮气(N2)。此 外,在空气中还含有微量的气态氮化物,如 NO、NO2、NH3 等。在陆地和海洋中也含有种 类繁多的无机和有机氮化物,包括生物体内的含氮化合物。氮元素可以有多种不同的氧化 水平,从-3 价到+5 价,如表 9-6 所示。 自然界中的不同氮化物经常发生互相转化,形成一个氮素循环(nitrogen cycle)。大气 中的氮气,通过生物固氮、工业固氮、大气固氮(如闪电)而转变为氨或硝酸盐,进入土 壤中。土壤中的氨在硝化细菌(包括亚硝酸细菌和硝酸细菌)的作用下,发生硝化作用而 氧化为硝酸盐。土壤中的氨和硝酸盐被植物吸收后,用以构成植物体内的蛋白质及其他氮
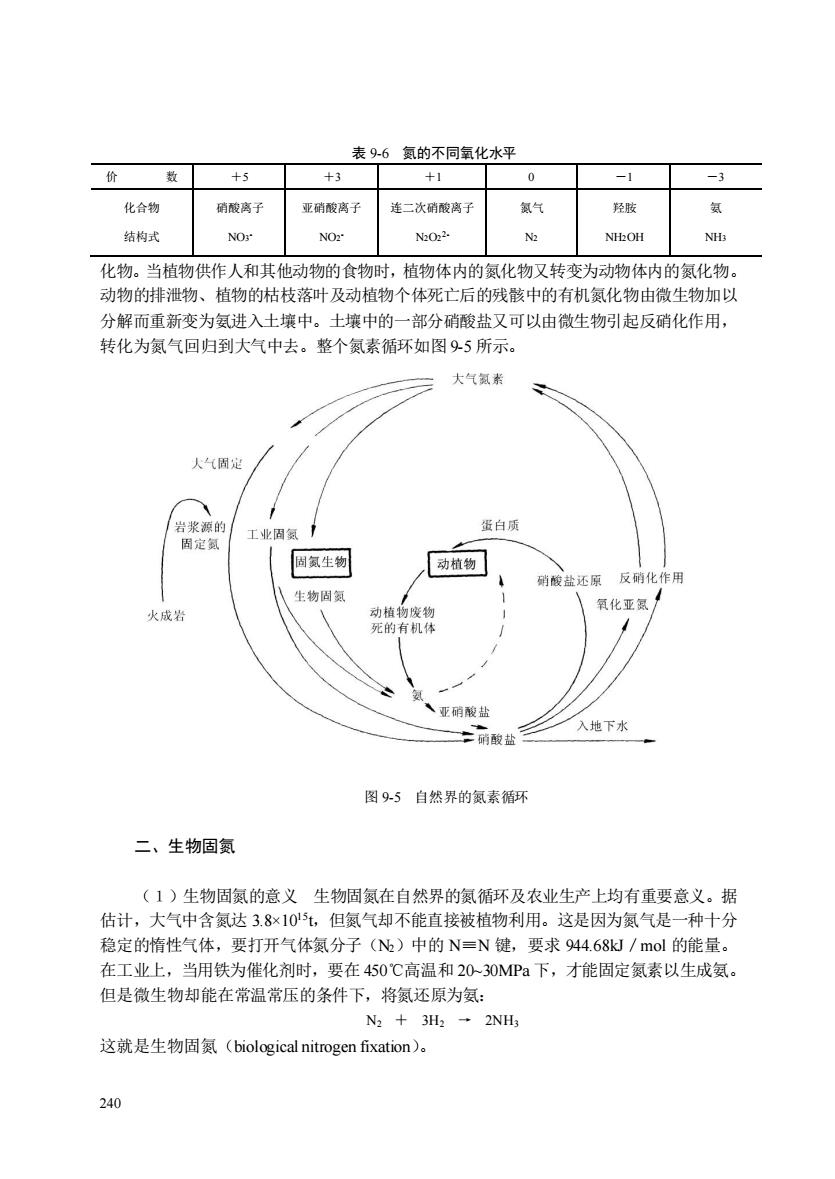
表96氨的不同氧化水平 价 数 +5 +3 0 -1 -3 化合物 硝酸离子 亚硝酸离子 连二次硝酸离子 气 羟胶 结构式 NOr NO2 NH2OH NH: 化物。当植物供作人和其他动物的食物时,植物体内的氮化物又转变为动物体内的氮化物。 动物的排泄物、植物的枯枝落叶及动植物个体死亡后的残骸中的有机氮化物由微生物加以 分解而重新变为氨进入土壤中。土壤中的一部分硝酸盐又可以由微生物引起反硝化作用, 转化为氮气回归到大气中去。整个氮素循环如图95所示。 大气氯素 人气是 蛋白质 固氮生物 动植物 硝酸盐还原反硝化作用 物固 氧化亚氨/ 成 、亚硝酸盐 丽酸盐 入地下水 图95自然界的氮素循环 二、生物固氨 (1)生物固氮的意义生物固氮在自然界的氮循环及农业生产上均有重要意义。据 估计,大气中含氮达3.8×105t,但氮气却不能直接被植物利用。这是因为氮气是一种十分 稳定的惰性气体,要打开气体氮分子(N)中的N=N键,要求94468/mol的能量 在工业上,当用铁为催化剂时,要在450℃高温和20-30MPa下,才能固定氮素以生成氨。 但是微生物却能在常温常压的条件下,将氮还原为氨: N2+3H→2NH 这就是生物固氮(biological nitrogen fixation)。 240
240 表 9-6 氮的不同氧化水平 价 数 +5 +3 +1 0 -1 -3 化合物 结构式 硝酸离子 NO3 - 亚硝酸离子 NO2 - 连二次硝酸离子 N2O2 2- 氮气 N2 羟胺 NH2OH 氨 NH3 化物。当植物供作人和其他动物的食物时,植物体内的氮化物又转变为动物体内的氮化物。 动物的排泄物、植物的枯枝落叶及动植物个体死亡后的残骸中的有机氮化物由微生物加以 分解而重新变为氨进入土壤中。土壤中的一部分硝酸盐又可以由微生物引起反硝化作用, 转化为氮气回归到大气中去。整个氮素循环如图 9-5 所示。 图 9-5 自然界的氮素循环 二、生物固氮 (1)生物固氮的意义 生物固氮在自然界的氮循环及农业生产上均有重要意义。据 估计,大气中含氮达 3.8×1015t,但氮气却不能直接被植物利用。这是因为氮气是一种十分 稳定的惰性气体,要打开气体氮分子(N2)中的 N≡N 键,要求 944.68kJ/mol 的能量。 在工业上,当用铁为催化剂时,要在 450℃高温和 20~30MPa 下,才能固定氮素以生成氨。 但是微生物却能在常温常压的条件下,将氮还原为氨: N2 + 3H2 → 2NH3 这就是生物固氮(biological nitrogen fixation)