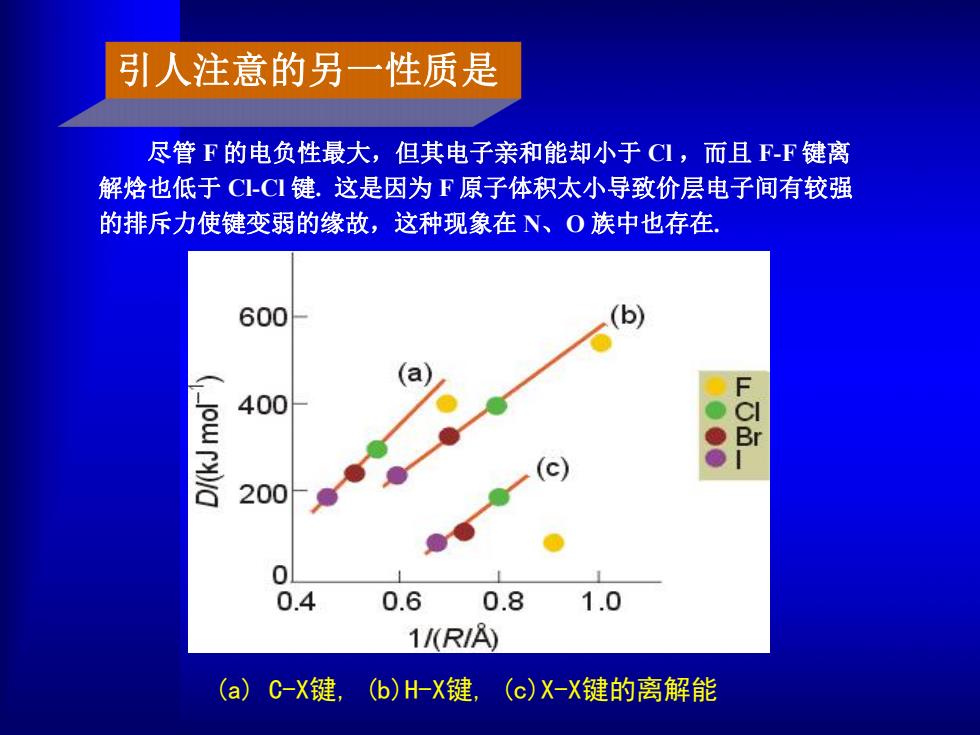
引人注意的另一性质是 尽管F的电负性最大,但其电子亲和能却小于CI,而且FF键离 解焓也低于C-C键.这是因为F原子体积太小导致价层电子间有较强 的排斥力使键变弱的缘故,这种现象在N、O族中也存在 600 400 Br 200 0 0.4 0.6 0.8 1.0 1/(RIA) (a)C-X键,(b)H-X键,(c)X-X键的离解能
尽管 F 的电负性最大,但其电子亲和能却小于 Cl ,而且 F-F 键离 解焓也低于 Cl-Cl 键. 这是因为 F 原子体积太小导致价层电子间有较强 的排斥力使键变弱的缘故,这种现象在 N、O 族中也存在. (a) C-X键, (b)H-X键, (c)X-X键的离解能 引人注意的另一性质是
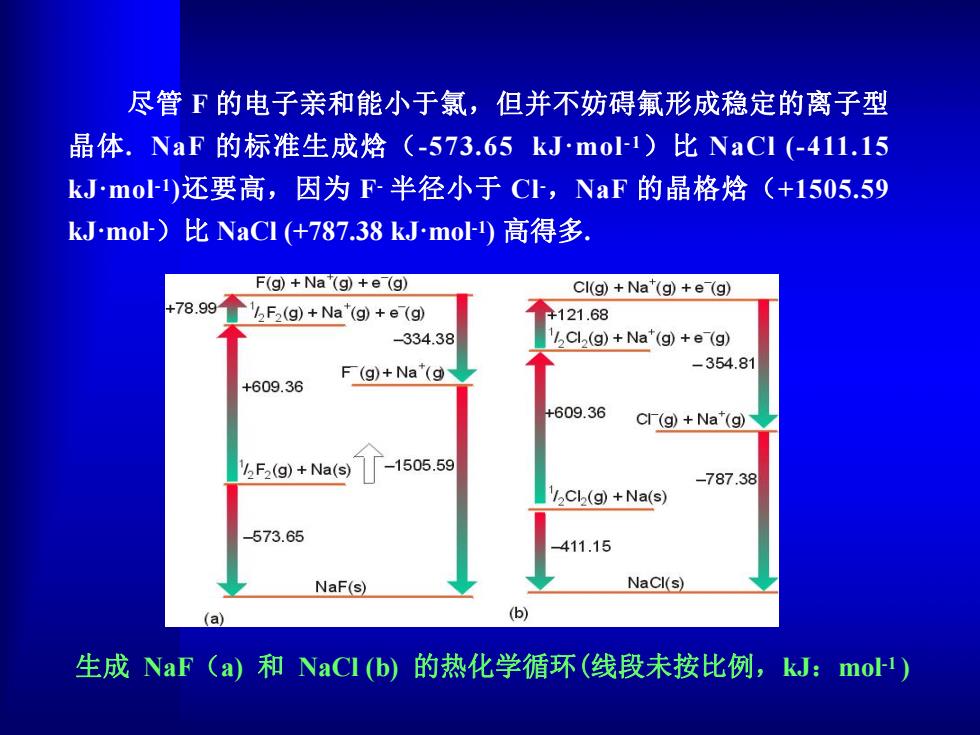
尽管F的电子亲和能小于氯,但并不妨碍氟形成稳定的离子型 晶体.NaF的标准生成焓(-573.65kJmo1)比NaCl(-411.15 kJmo)还要高,因为F-半径小于C,NaF的晶格焓(+1505.59 kJ.mol-)比NaCl(+787.38kJmo)高得多. F(g)+Na"(g)+e(g) CI(g)+Na(g)+e(g) 78.99 F(g)+Na"(g)+e(g) +121.68 -334.38 Cl(g)+Na"(g)+e (g) -354.81 F(g)+Na"(g +609.36 +609.36 Cl(g)+Na"(g) F(g)+Na(s) 1505.59 -787.38 Cl(g)+Na(s) 573.65 411.15 NaF(s) NaCl(s) (a) (b) 生成NaF(a)和NaCI(b)的热化学循环(线段未按比例,kJ:mo1)
尽管 F 的电子亲和能小于氯,但并不妨碍氟形成稳定的离子型 晶体. NaF 的标准生成焓(-573.65 kJ·mol -1)比 NaCl (-411.15 kJ·mol -1)还要高,因为 F- 半径小于 Cl -,NaF 的晶格焓(+1505.59 kJ·mol -)比 NaCl (+787.38 kJ·mol -1) 高得多. 生成 NaF(a) 和 NaCl (b) 的热化学循环(线段未按比例,kJ:mol -1 )
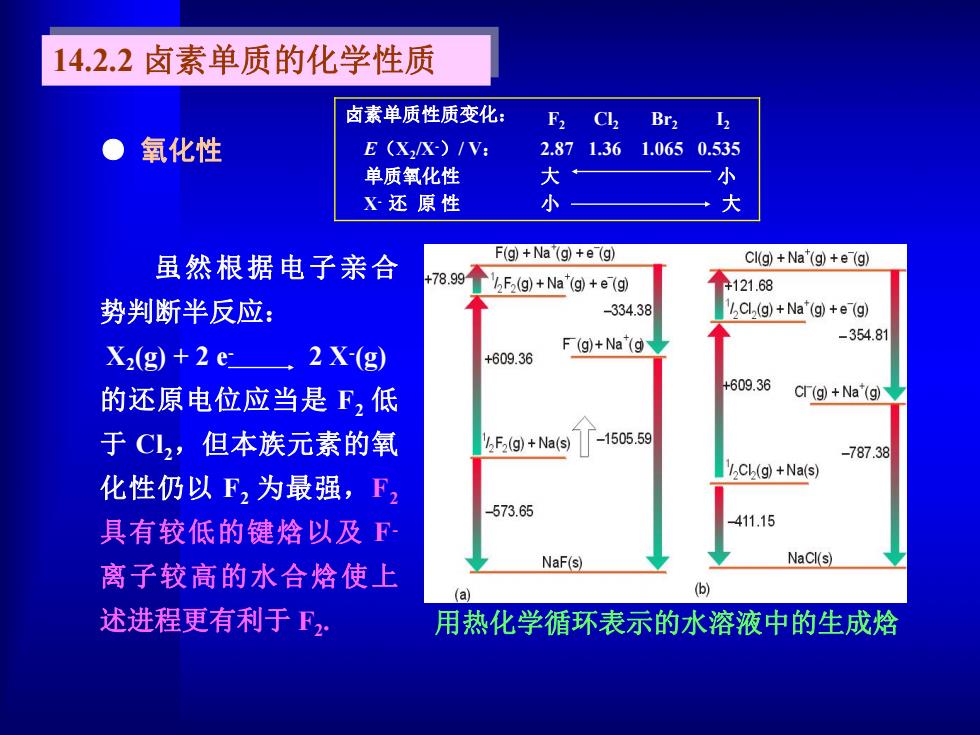
14.2.2卤素单质的化学性质 卤素单质性质变化: F2 CL Br212 氧化性 E (X2/X-)/V: 2.871.36 1.0650.535 单质氧化性 大 小 X还原性 大 虽然根据电子亲合 F(g)+Na(g)+e(g) Cl(g)+Na"(g)+e(g) +78.991 F2(g)+Na"(g)+e(g) +121.68 势判断半反应: -334.38 Cl(g)+Na"(g)+e(g) X2(g)+2 e 2X-(g F(g)+Na"(g -354.81 +609.36 +609.36 的还原电位应当是F,低 Cr(g)+Na"(g) 于C12,但本族元素的氧 2F2(g)+Na(s) -1505.59 -787.38 Cl(g)+Na(s) 化性仍以F,为最强,F 573.65 具有较低的键焓以及F 411.15 NaF(s) NaCl(s) 离子较高的水合焓使上 (a) (b) 述进程更有利于F, 用热化学循环表示的水溶液中的生成焓
● 氧化性 卤素单质性质变化: F2 Cl2 Br2 I2 2.87 1.36 1.065 0.535 大 小 小 大 E(X2 /X-)/ V: 单质氧化性 X- 还 原 性 用热化学循环表示的水溶液中的生成焓 虽然根据电子亲合 势判断半反应: X2(g) + 2 e - 2 X-(g) 的还原电位应当是 F2 低 于 Cl2,但本族元素的氧 化性仍以 F2 为最强,F2 具有较低的键焓以及 F- 离子较高的水合焓使上 述进程更有利于 F2 . 14.2.2 卤素单质的化学性质

● 与水的反应 发生氧化反应X2+2H,0一4X+02激烈程度:F2>C2>Br2 发生岐化反应X2+HO一HXO+HX K(C12)=4.8×104 K(Br2)=5.0X10-9 因此:C2>Br2>2 K2)=3.0X10-13 由于K很小,难怪人们将其水溶液叫“氯水”、“溴水”和“碘 水” 在碱存在下,促进X,在0中的溶解,岐化: X2+2O一X+X0+H0 3X2+60H- 5X-+X03+3H20 CL2在20℃时只有前一反应进行,70℃时后一反应才进行得很快: Br2在20℃时两个反应都进行很快,0℃时后一反应才较缓慢; I2在0℃时后一反应也进行得很快,所以I2与碱反应只能得到碘酸盐
● 与水的反应 发生氧化反应 X2 + 2 H2O 4HX + O2 激烈程度:F2﹥Cl2﹥Br2 发生岐化反应 X2 + H2O HXO + HX K(Cl2)=4.8×10-4 K(Br2)=5.0×10-9 因此:Cl2﹥Br2﹥I2 K(I2) =3.0×10-13 由于K 很小,难怪人们将其水溶液叫“氯水” 、 “溴水”和“碘 水”. 在碱存在下,促进 X2在 H2O 中的溶解,岐化: X2 + 2 OH- X- + XO- + H2O 3X2 + 6OH- 5X- + XO3 - + 3H2O Cl2 在20℃时只有前一反应进行,70℃时后一反应才进行得很快; Br2 在 20℃时两个反应都进行很快,0℃时后一反应才较缓慢; I2 在0℃时后一反应也进行得很快,所以I2与碱反应只能得到碘酸盐

F2与H,0的反应特殊 F2与H20反应强烈,并有燃烧现象,不仅放出O2,同时生成 少量OF2、H202和O3: F2+H20→2HF+O 2002 30→03 0+H20一H202 0+F2一OF2 因而HOF的发现比其他几个次卤酸晚得多.20世纪70年代早期 控制F2和冰的反应(-40℃)离析出了HOF,产率近50%: F2(g)+H2O (s) 小HOF(g)+HF(g)
F2与 H2O 反应强烈,并有燃烧现象,不仅放出 O2,同时生成 少量 OF2、H2O2和 O3: 因而 HOF 的发现比其他几个次卤酸晚得多. 20 世纪 70 年代早期 控制 F2 和冰的反应(-40℃)离析出了HOF,产率近 50%: F2 + H2O 2 HF + O 2O O2 3O O3 O + H2O H2O2 O + F2 OF2 F2 (g) + H2O (s) HOF (g) + HF (g) 冰 F2与 H2O 的反应特殊