
从上表可见: (1)卤素是典型的非金属元素; (2)卤素具有丰富的氧化还原化学特征: 。一方面指元素本身能形成多种氧化态的事实 。另一方面指可使其他元素达到通常难以达到的氧化态: F可以稳定元素的高氧化态:VFs、MoF和ReF, 3)氟化学的研究导致稀有气体化合物的发现
(1) 卤素是典型的非金属元素; (2) 卤素具有丰富的氧化还原化学特征: ●一方面指元素本身能形成多种氧化态的事实 ●另一方面指可使其他元素达到通常难以达到的氧化态: F- 可以稳定元素的高氧化态:VF5、MoF6和ReF7 (3) 氟化学的研究导致稀有气体化合物的发现。 从上表可见:

14.1.2 卤素的存在 卤素主要以卤化物形式存在于自然界.氟的资源是CaF2(荧石) 、冰晶石和磷灰石;氯、溴是海水和盐湖卤水;碘是碘酸盐沉积,主 要是智利硝石 萤石 冰晶石 智利硝石 CaF2 3NaF.AlF3 NalO3 14.1.3卤素的电势图 (自学)
14.1.2 卤素的存在 卤素主要以卤化物形式存在于自然界. 氟的资源是 CaF2(荧石) 、冰晶石和磷灰石;氯、溴是海水和盐湖卤水;碘是碘酸盐沉积,主 要是智利硝石. 萤石 CaF2 冰晶石 3NaF.AlF3 智利硝石 NaIO3 14.1.3 卤素的电势图 (自学)
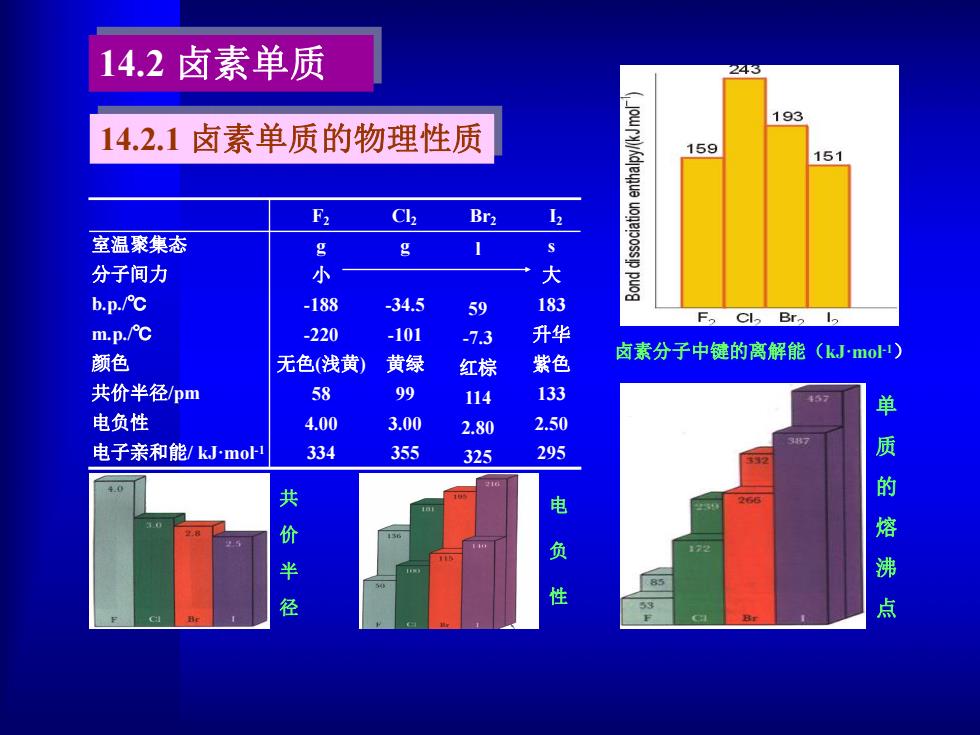
14.2卤素单质 2233 193 14.2.1卤素单质的物理性质 159 151 F C Br2 室温聚集态 g g 分子间力 小 大 b.p./℃ -188 34.5 59 183 F2 Br m.p./℃ -220 -101 -7.3 升华 颜色 卤素分子中键的离解能(kJmo) 无色(浅黄) 黄绿 红棕 紫色 共价半径pm 58 99 114 133 45 单 电负性 4.00 3.00 2.80 2.50 电子亲和能/kJmo1 334 355 325 295 质 的 共价半 电 熔 负 沸 径 性 点
F2 Cl2 Br2 I2 室温聚集态 分子间力 b.p./℃ m.p./℃ 颜色 共价半径/pm 电负性 电子亲和能/ kJ·mol -1 g 小 -188 -220 无色(浅黄) 58 4.00 334 g -34.5 -101 黄绿 99 3.00 355 l 59 -7.3 红棕 114 2.80 325 s 大 183 升华 紫色 133 2.50 295 卤素分子中键的离解能(kJ·mol -1) 单 质 的 熔 沸 点 电 负 性 共 价 半 径 14.2.1 卤素单质的物理性质 14.2 卤素单质
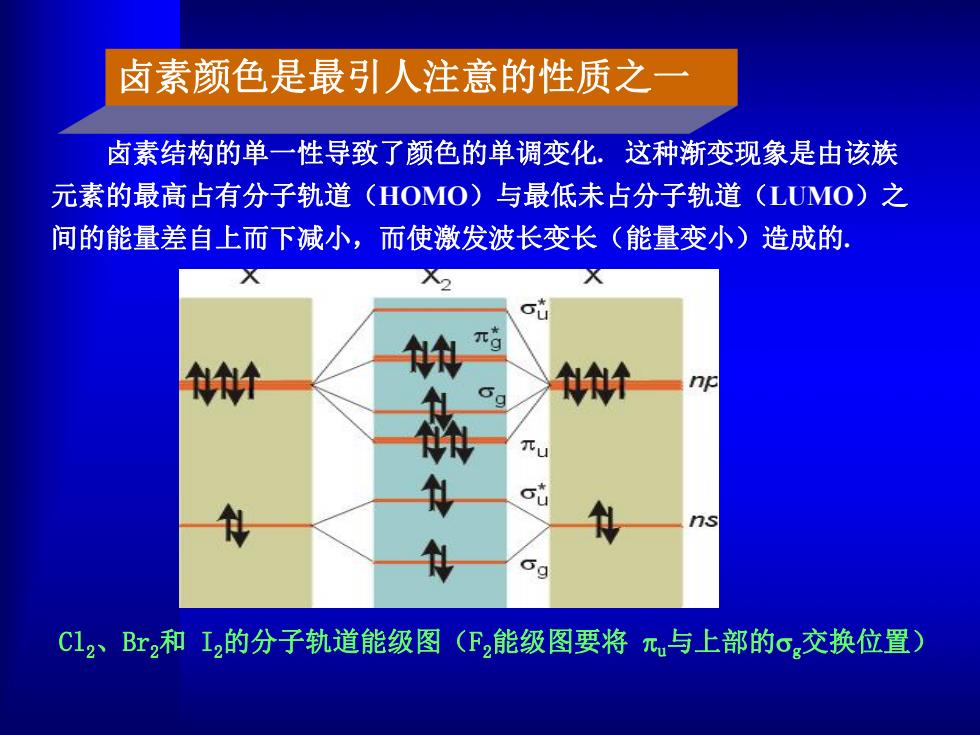
卤素颜色是最引人注意的性质之一 卤素结构的单一性导致了颜色的单调变化.这种渐变现象是由该族 元素的最高占有分子轨道(HOMO)与最低未占分子轨道(LUMO)之 间的能量差自上而下减小,而使激发波长变长(能量变小)造成的. 针 快 g 计 np 门S C12、Br2和I2的分子轨道能级图(F2能级图要将元与上部的o交换位置
卤素结构的单一性导致了颜色的单调变化. 这种渐变现象是由该族 元素的最高占有分子轨道(HOMO)与最低未占分子轨道(LUMO)之 间的能量差自上而下减小,而使激发波长变长(能量变小)造成的. Cl2、Br2和 I2的分子轨道能级图(F2能级图要将 u与上部的g交换位置) 卤素颜色是最引人注意的性质之一
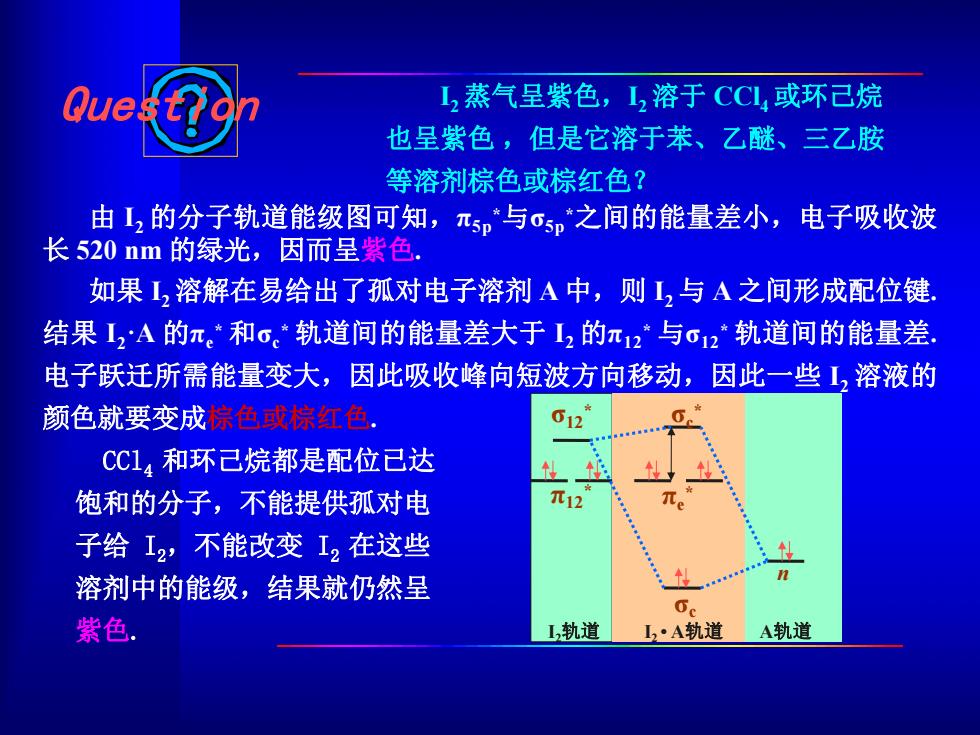
Que L,蒸气呈紫色,L,溶于CCL或环已烷 也呈紫色,但是它溶于苯、乙醚、三乙胺 等溶剂棕色或棕红色? 由2的分子轨道能级图可知,元5p与@5p之间的能量差小,电子吸收波 长520nm的绿光,因而呈紫色. 如果1,溶解在易给出了孤对电子溶剂A中,则L,与A之间形成配位键 结果I2A的π。*和o。轨道间的能量差大于I2的π12与c2轨道间的能量差 电子跃迁所需能量变大,因此吸收峰向短波方向移动,因此一些1,溶液的 颜色就要变成棕色或棕红色 012 CC14和环己烷都是配位已达 饱和的分子,不能提供孤对电 元12 子给I2,不能改变I2在这些 n 溶剂中的能级,结果就仍然呈 6 紫色. L,轨道 L2·A轨道 A轨道
由 I2 的分子轨道能级图可知,π5p *与σ5p *之间的能量差小,电子吸收波 长 520 nm 的绿光,因而呈紫色. 如果 I2 溶解在易给出了孤对电子溶剂 A 中,则 I2 与 A 之间形成配位键. 结果 I2·A 的πe * 和σc * 轨道间的能量差大于 I2 的π12 * 与σ12 * 轨道间的能量差. 电子跃迁所需能量变大,因此吸收峰向短波方向移动,因此一些 I2 溶液的 颜色就要变成棕色或棕红色. CCl4 和环己烷都是配位已达 饱和的分子,不能提供孤对电 子给 I2,不能改变 I2 在这些 溶剂中的能级,结果就仍然呈 紫色. Question I2蒸气呈紫色,I2溶于 CCl4或环己烷 也呈紫色 ,但是它溶于苯、乙醚、三乙胺 等溶剂棕色或棕红色? σ12 * π12 * σc * πe * σc n I2轨道 I2 • A轨道 A轨道