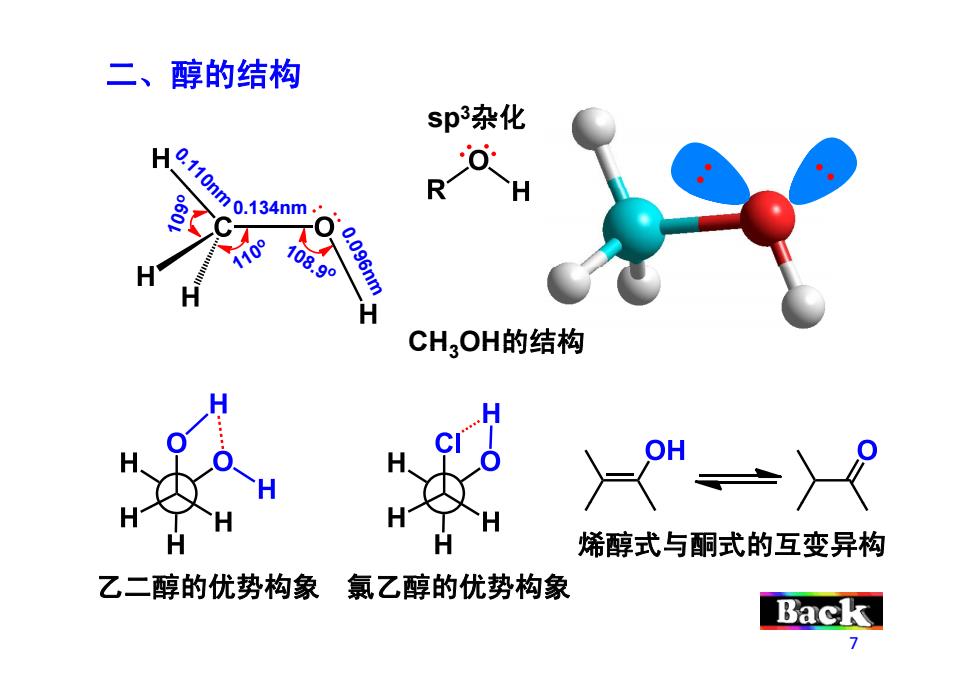
二、醇的结构 sp杂化 07>。3gm- 可 R H 108.99 0.096nm CH3OH的结构 、冷 >-y 烯醇式与酮式的互变异构 乙二醇的优势构象氯乙醇的优势构象 Back
二、醇的结构 sp3杂化 0.110nm 0 .096 0.134nm 109o 110o 108 9 6nm 1 8.9o CH3OH的结构 乙二醇的优势构象 氯乙醇的优势构象 烯醇式与酮式的互变异构 7

§10.1.2 醇的化学性质 B-H消除 取代、消除 酸性、生成酯 碱性、 亲核性、氢键 a-H氧化、脱氢 8
§10.1.2 醇的化学性质 β-H消除 取代、消除 酸性、生成酯 α-H氧化、脱氢 碱性、亲核性、氢键 α-H氧化、脱氢 8

一、醇的酸碱性 1、醇的弱酸性 HOH CH3OH CH3CH2OH (CH3)2CHOH (CH3)3COH pKa 15.7 16 17 18 19 酸性H20>1ROH>2ROH>3ROH 原因: (1)、电子效应一烷基推电子,一方面使O-H键难断裂, 另一方面也使RO带的负电荷增多,不稳定; (2)、空间效应一烷基空间位阻使RO难溶剂化,不稳 定。 酸性 CH3CH2OH<CICH2CH,OH<CI3CCH2OH
一、醇的酸碱性 1、醇的弱酸性 HOH CH3OH CH3CH2OH (CH3)2CHOH (CH3) HOH CH3OH CH3CH2OH (CH3)2CHOH (CH3)3COH pKa 15.7 16 17 18 19 酸性 H2O > 1oROH > 2oROH > 3oROH 原因: (1)、电子效应——烷基推电子,一方面使O-H键难断裂, 另 方面也使 O 带的负电荷增多 不稳定 原因 另一方面也使RO-带的负电荷增多,不稳定; (2)、空间效应——烷基空间位阻使RO-难溶剂化,不稳 定。 酸性 CH CH OH < ClCH CH OH < Cl CCH OH 9 酸性 CH3CH2OH < ClCH2CH2OH < Cl3CCH2OH
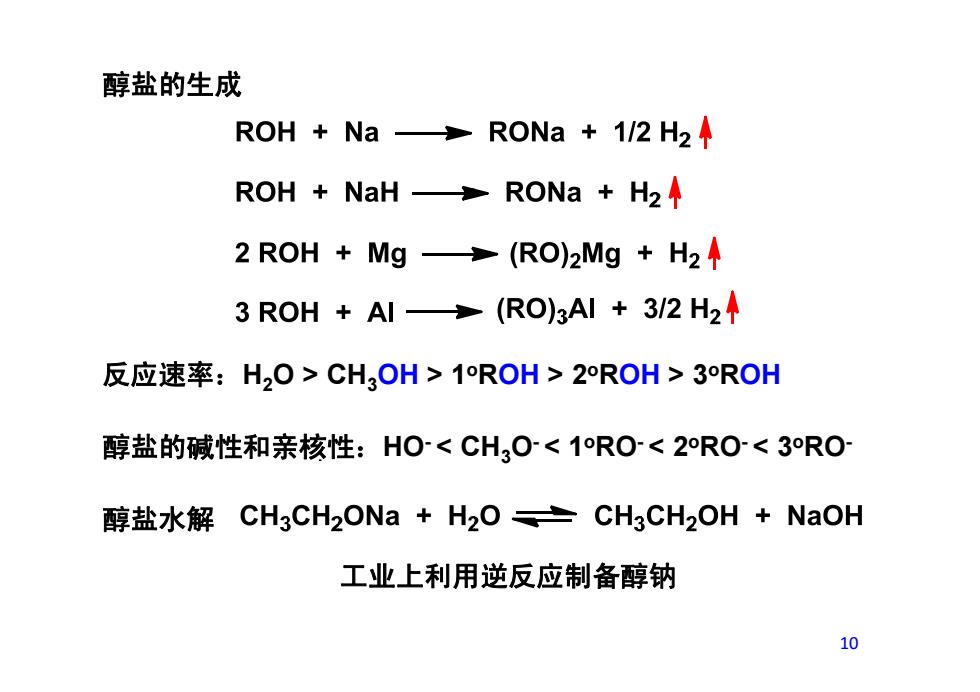
醇盐的生成 ROH Na RONa 1/2 H2A ROH NaH>RONa H2 2 ROH Mg(RO)2Mg H2 3 ROH +Al(RO)3AI 3/2 H2 反应速率:H,O>CH3OH>1ROH>2ROH>3ROH 醇盐的碱性和亲核性:H<CH3O<1RO<2RO<3RO 醇盐水解CH3CH2ONa+H2O亡CH3CH2OH+NaOH 工业上利用逆反应制备醇钠 10
醇盐的生成 反应速率:H2O > CH3OH > 1oROH > 2oROH > 3oROH 醇盐的碱性和亲核性:HO- < CH3O- < 1oRO- < 2oRO- < 3oRO- 醇盐水解 工业上利用逆反应制备醇钠 10
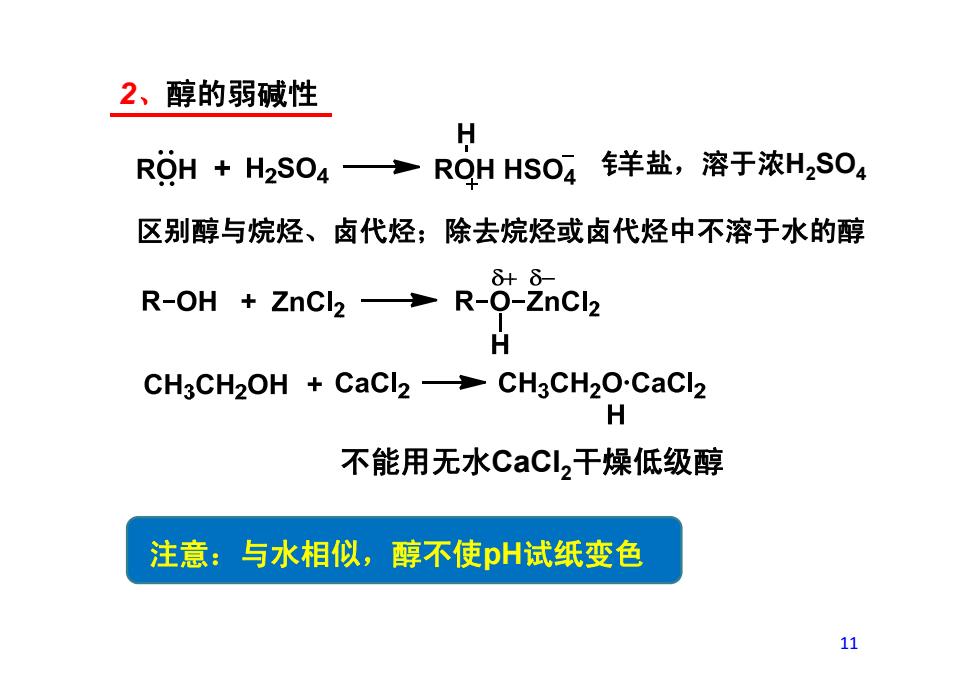
2、醇的弱碱性 H ROH +H2SO4 ROH HSO4羊盐,溶于浓H2SO4 区别醇与烷烃、卤代烃;除去烷烃或卤代烃中不溶于水的醇 δ+8- R-OH+ZnCl2→R-0-znC2 CH3CH2OH CaCl2->CH3CH2O-CaCl2 H 不能用无水CaCl,干燥低级醇 注意:与水相似,醇不使pH试纸变色 11
2、醇的弱碱性 钅羊盐,溶于浓H2SO4 区别醇与烷烃、卤代烃;除去烷烃或卤代烃中不溶于水的醇 不能用无水CaCl2干燥低级醇 注意:与水相似,醇不使pH试纸变色 11