
说明:(2)R':独立的浓度关系数; 可能是由于化学反应的进行而产生,也可能是指定的, 但只对同相的物质有意义。 例:1.在一抽空的容器中放入PCl5,达分解平衡后 ,生成PCL3(g)和C2(g)。问K=? 答:R=1,R'=1,故K=1。 2.在抽空的容器中放入CaC03,让其发生分解 反应。问K=? 答:R=1,R'=0,故K=2
说明: (2)R’:独立的浓度关系数; 可能是由于化学反应的进行而产生,也可能是指定的, 但只对同相的物质有意义。 例:1. 在一抽空的容器中放入PCl5,达分解平衡后 ,生成PCl3(g)和Cl2 (g)。问K=? 答:R=1,R’=1,故K=1。 2.在抽空的容器中放入CaCO3,让其发生分解 反应。问K=? 答:R=1,R’=0,故K=2

说明:(3)一个系统的物种数可以随着考虑问题的出 发点不同而不同,但在平衡系统中组分数是确定的。 例3NaC-HO系统 1.NaCl,H20:S=2,R=O,R'=0,K=2 2.NaCl不饱和水溶液 Na+,CI-,H20:S=3, R=0,R'=1:Nat]=[CI-], K=3-1=2 3.NaCI饱和水溶液,有NaCI(s)存在 NaCI(s),Na,CI,H2O:S=4, R=l:NaCI(s)台Na+CI, R'=1:[Na+]=[CI], K=4-1-1=2
说明: (3)一个系统的物种数可以随着考虑问题的出 发点不同而不同,但在平衡系统中组分数是确定的。 例3 NaCl-H2O系统 1. NaCl,H2O: S=2, R=0, R’=0, K=2 2. NaCl不饱和水溶液 Na+ , Cl-, H2O : S=3, R=0, R’=1: [Na+ ]=[Cl-], K= 3– 1=2 3. NaCl饱和水溶液,有NaCl(s)存在 NaCl(s), Na+ , Cl-, H2O : S=4, R=1: NaCl(s) Na++ Cl-, R’=1: [Na+ ]=[Cl-], K= 4 – 1– 1=2

4.NaCI(s),Na,CI,H2O,H+,OH-: S=6, R=2:NaCl(s)台Na+CI,H20台H++OH-, R'=2:Na]=[CI-],H]=[OH-], 电中性Na+H=CI-+[OH], K=6-2-2=2 练习:P144,习题1
4. NaCl(s), Na+ , Cl-, H2O ,H+ , OH-: S=6, R=2: NaCl(s) Na++ Cl-, H2O H+ + OH-, R’=2: [Na+ ]=[Cl-], [H+ ]=[OH-], 电中性 [Na+ ]+[H+ ]=[Cl-]+[OH-], K=6– 2–2=2 练习:P144,习题1

3.自由度f(degrees of freedom) 在不引起旧相消失和新相形成的前提下,能够在一 定范围内独立变动的强度性质称作系统的自由度。 即能确立系统状态的独立变量。如工,p,c 例:①一杯水和一桶水: 工p,户2,状态相同,不用确定系统的大小; ②NaCI(sln): T,p,C,=3 ③NaCI(饱和):T,p,2(浓度确定c=f(D) ④H200-H20g)共存系统: 1。因工,p中只有一个独立变量p=f(①
3. 自由度f (degrees of freedom) 例: ①一杯水和一桶水: 在不引起旧相消失和新相形成的前提下,能够在一 定范围内独立变动的强度性质称作系统的自由度。 即能确立系统状态的独立变量。如T, p, c T, p, f=2,状态相同,不用确定系统的大小; T, p, c, f=3 T, p, f=2(浓度确定c=f (T)) f=1。因T, p中只有一个独立变量 p=f (T) 。 ② NaCl(sln): ③ NaCl(饱和): ④ H2O(l)-H2O(g)共存系统:
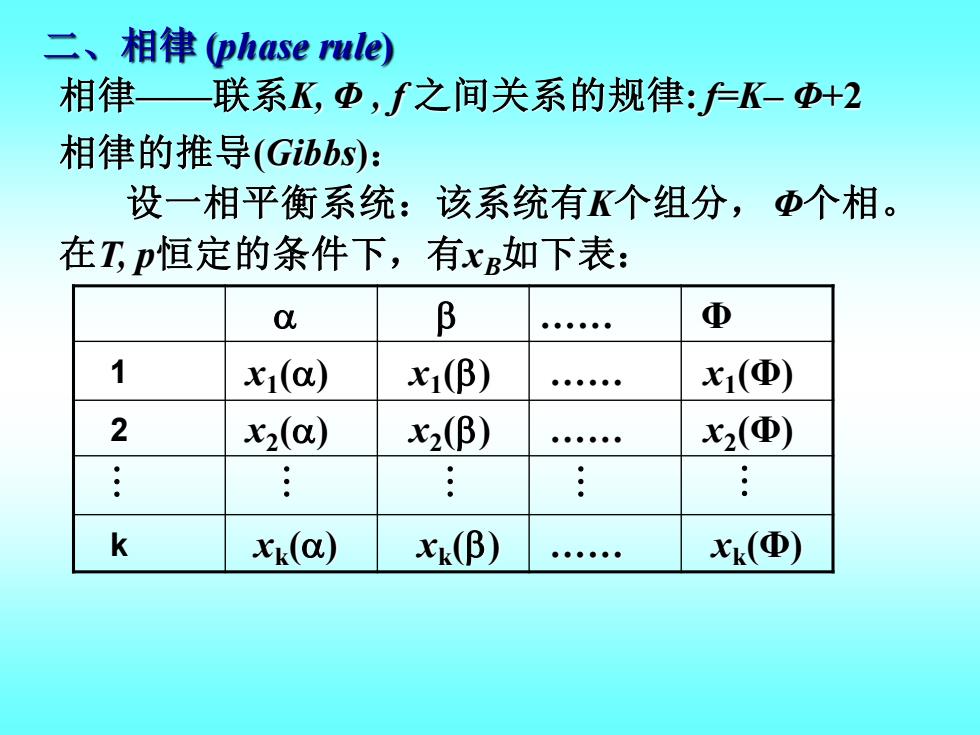
二、相律(phase rule) 相律—联系K,中,之间关系的规律:户K-Φ+2 相律的推导(Gibbs): 设一相平衡系统:该系统有K个组分,Φ个相。 在T,p恒定的条件下,有如下表: 0 B ●●●●●● Φ 1 x1(a) x1(β) x1(Φ) 2 x2() x2(β) x2(Φ) k xx(a) X(β) Xk(Φ)
二、相律 (phase rule) 相律——联系K, Φ , f 之间关系的规律: f=K– Φ+2 . Φ 1 2 k 相律的推导(Gibbs): 设一相平衡系统:该系统有K个组分,Φ个相。 在T, p恒定的条件下,有xB如下表: x1 () x2 () xk () x1 () x2 () xk () . . . x1 (Φ) x2 (Φ) xk (Φ)