
第二节反应机理和元反应三、质量作用定律与速率方程式2.反应速率方程式:表示反应物浓度与反应速率之间定量关系的数学式称为反应速率方程式①对元反应,根据质量作用定律可直接写出速率方程式如上例v = k c(NO2) c(CO)一般地aA+bBdD+eBV=kca(A)cb(B反应分子数=a+b
第二节 反应机理和元反应 三、质量作用定律与速率方程式 2. 反应速率方程式:表示反应物浓度与反应速率 之间定量关系的数学式称为反应速率方程式。 ① 对元反应,根据质量作用定律可直接写出速 率方程式: 如上例 v = k c(NO2 ) c(CO) 一般地 aA+bB→dD+eE v = k ca (A) c b (B) 反应分子数 = a+b

第二节反应机理和元反应2对复合反应,速率方程式需由实验测出如反应2N205(g)4NO2(g)+O2(g)实验证明v仅与c(N,O)而不是与c2(NO)成正比V=k c(N,Os)研究表明上述反应分3步进行一般地aA+bB-→dD+eEy=kcm(A)cn(B
第二节 反应机理和元反应 ② 对复合反应,速率方程式需由实验测出。 如反应 实验证明v仅与c(N2O5 ) 而不是与c 2 (N2O5 )成正比 v =k c(N2O5 ) 研究表明上述反应分3步进行。 一般地 aA+bB→dD+eE v = k cm(A) c n (B) 2N2 O5 (g) 4NO2 (g)+O2 (g)

第二节反应机理和元反应3.反应级数(reactionorder)反应:aA+bB-→dD+eEv=kcm(A) ch(B)m一A的反应级数n一B的反应级数总的反应级数=m+n注意,简单反应:反应分子数=反应级数:mta或(和)ntb,复合反应m=α且n=b,不一定是元反应
第二节 反应机理和元反应 3. 反应级数(reaction order) 反应: aA+bB→dD+eE v = k cm(A) c n (B) • m—A的反应级数 • n—B的反应级数 • 总的反应级数= m + n ◼ 注意,简单反应:反应分子数=反应级数; m≠a 或(和)n≠b,复合反应; m=a 且n=b,不一定是元反应
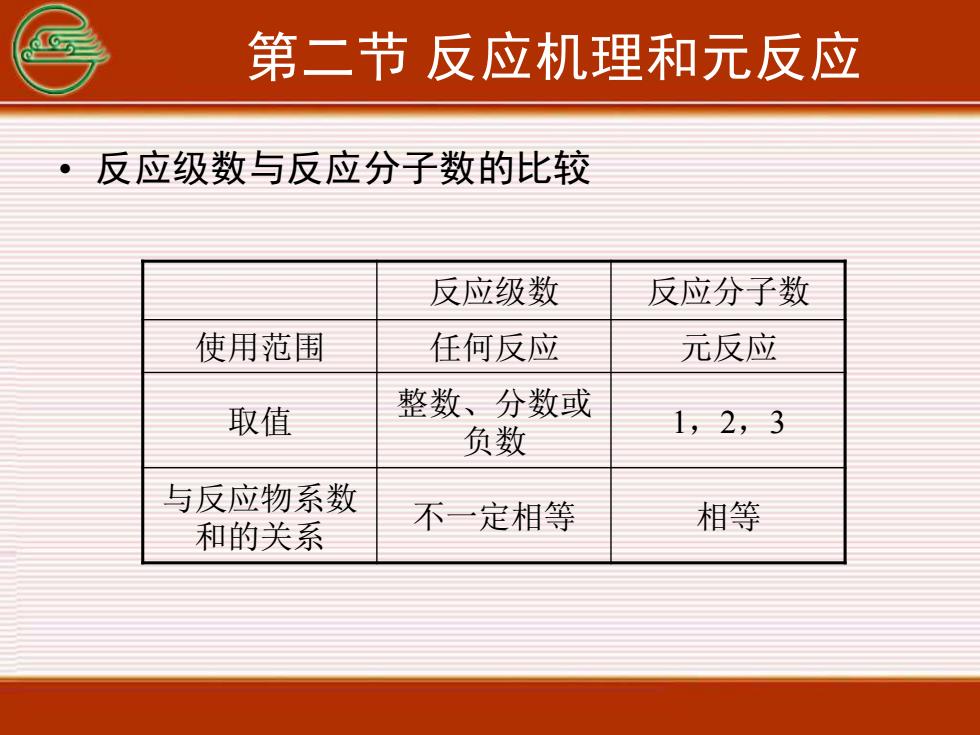
第二节反应机理和元反应反应级数与反应分子数的比较反应级数反应分子数元反应使用范围任何反应整数、分数或取值1, 2, 3负数与反应物系数相等不一定相等和的关系
第二节 反应机理和元反应 • 反应级数与反应分子数的比较 反应级数 反应分子数 使用范围 任何反应 元反应 取值 整数、分数或 负数 1,2,3 与反应物系数 和的关系 不一定相等 相等