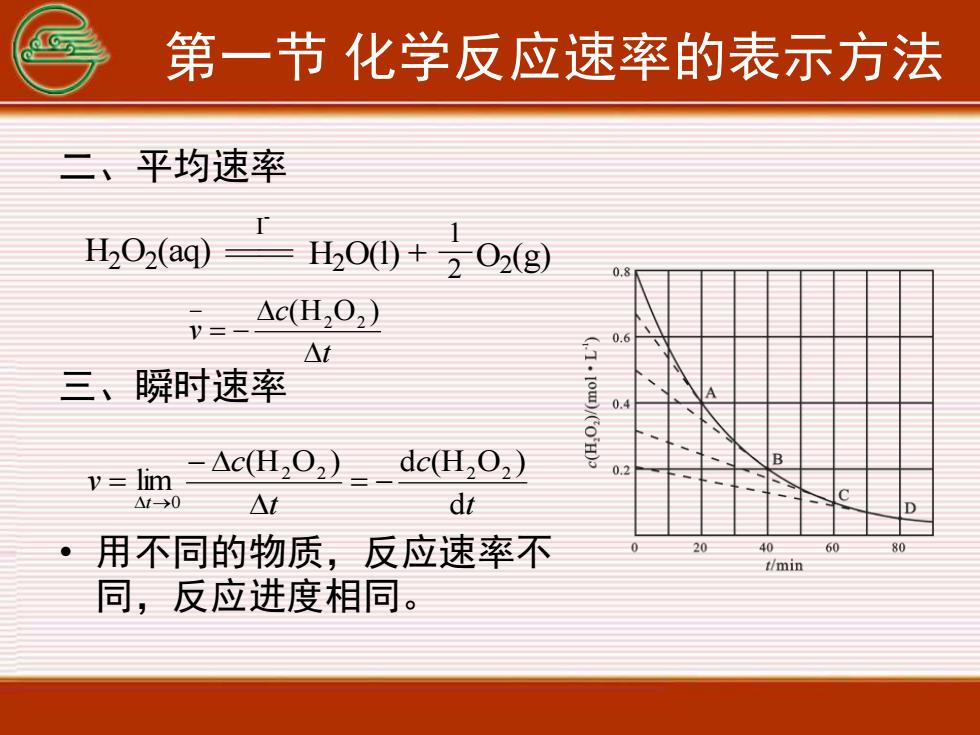
第一节化学反应速率的表示方法二、平均速率1H,O2(aq)H,O() +202(g)0.8Ac(H,0,)V=0.6(T.[0W)/COHAt三、瞬时速率0.Bdc(H,02)Ac(H,O)0.2limV=1CdtAtAt>0D20604080用不同的物质,反应速率不0t/min同,反应进度相同
第一节 化学反应速率的表示方法 二、平均速率 三、瞬时速率 • 用不同的物质,反应速率不 同,反应进度相同。 H2 O2 (aq) H2 O(l) + 1 2 O2 (g) I - t c v = − (H O ) 2 2 t c t c v t d (H O ) d (H O ) lim 2 2 2 2 0 = − − = →

第二节反应机理和元反应简单反应与复合反应简单反应:由一步完成的反应CO(g) + H,O (g)=CO2 (g) +H2 (g)2复合反应:经过多步完成的反应例:H2(g) + I(g) = 2Hl (g)由两步组成I2(g) = 21 (g)H(g) + 2I(g) = 2HI (g)
第二节 反应机理和元反应 一、简单反应与复合反应 1. 简单反应 :由一步完成的反应 CO(g) + H2O (g) = CO2 (g) + H2 (g) 2. 复合反应:经过多步完成的反应 例: H2 (g) + I2 (g) = 2HI (g) 由两步组成 I2 (g) = 2I (g) H2 (g) + 2I(g) = 2HI (g)

第二节反应机理和元反应一、简单反应与复合反应3.反应机理:化学反应进行的实际步骤,即实现化学反应的各步骤的微观过程例:总反应H2(g) + I(g) =2HI (g)快反应I2(g) = 2I (g)慢反应H2(g) + 2I(g) = 2HI (g)慢反应限制了整个复合反应的速率,故称速率控制步骤
第二节 反应机理和元反应 一、简单反应与复合反应 3. 反应机理:化学反应进行的实际步骤,即实现化 学反应的各步骤的微观过程。 例:总反应 H2 (g) + I2 (g) = 2HI (g) I2 (g) = 2I (g) 快反应 H2 (g) + 2I(g) = 2HI (g) 慢反应 • 慢反应限制了整个复合反应的速率,故称速率 控制步骤

第二节反应机理和元反应二、元反应和反应分子数1.元反应(elementaryreaction):一步就能完成的化学反应2.反应分子数(molecularityofreaction):元反应中反应物微粒数之和单分子反应 I (g) =21 (g)双分子反应CO(g) +H,O (g) =CO2 (g) + H2 (g)三分子反应 H2(g)+2I (g)=2HI(g)由于四分子同时相遇的机会极小,更高分子数的反应没有出现
第二节 反应机理和元反应 二、元反应和反应分子数 1. 元反应(elementary reaction):一步就能完成的 化学反应。 2. 反应分子数(molecularity of reaction):元反应中反 应物微粒数之和。 单分子反应 I2 (g) = 2I (g) 双分子反应 CO(g) + H2O (g) = CO2 (g) + H2 (g) 三分子反应 H2 (g) + 2I (g) = 2HI (g) • 由于四分子同时相遇的机会极小,更高分子数 的反应没有出现

第二节反应机理和元反应三、质量作用定律与速率方程式l:质量作用定律(lawofmassaction)温度一定时,元反应的反应速率与各反应物浓度以计量系数为指数的幂的乘积成正比aA+bB-→dD+eEv=kca(A)cb(B)例如NO2(g)+CO(g) 二 NO(g)+CO2(g)V= k c(NO,) c(CO)
第二节 反应机理和元反应 三、质量作用定律与速率方程式 1. 质量作用定律(law of mass action) • 温度一定时,元反应的反应速率与各反应物浓度 以计量系数为指数的幂的乘积成正比: aA+bB→dD+eE v = k c a (A) c b (B) 例如 v = k c(NO2 ) c(CO) NO2 (g)+CO(g) NO(g)+CO2 (g)