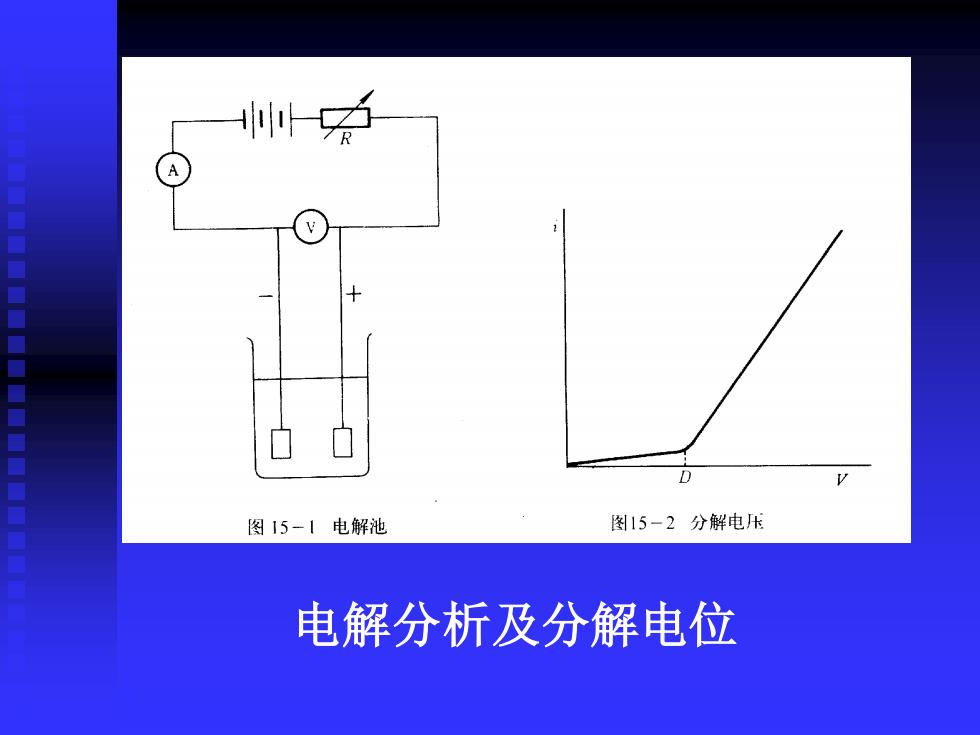
图15-1电解池 图15-2分解电压 电解分析及分解电位
电解分析及分解电位

AB,外加电压很小,几乎没有电流通过,V↑, 略↑ CD,外加电压增至一定数值,随V个急剧↑ C点即分解电压,电解物质在两电极上产 生迅速、连续不断的电极反应时可需的 最小外加电压,对可逆过程而言,其数 据等于它本身所构成的自发电动势
AB, 外加电压很小,几乎没有电流通过,V↑, i略↑ CD, 外加电压增至一定数值,i随V↑急剧↑ C点即分解电压,电解物质在两电极上产 生迅速、连续不断的电极反应时可需的 最小外加电压,对可逆过程而言,其数 据等于它本身所构成的自发电动势

E分=E反=E阳一E霸 而外加电压为V外=卫分+R Cu2++2e Cu p平=p°+RT/nF)lnCu2+1 P阴=p平反应处于平衡状态 P阴<p平ICu2+]减少,析出Cu 析出电位就是平衡时的电极电位 在阴极上,析出电位愈正者,愈易还原,而在 阳极上析出电位愈负者,愈易氧化
E分 = E反 = E阳 — E阴 而外加电压为 V外 = E分 + iR Cu2+ + 2e = Cu φ平 = φø+ (RT/nF)ln[Cu2+ ] φ阴 = φ平 反应处于平衡状态 φ阴﹤φ平 [Cu2+ ]减少,析出Cu 析出电位就是平衡时的电极电位 在阴极上,析出电位愈正者,愈易还原,而在 阳极上析出电位愈负者,愈易氧化

如:Cu,Pb,Cd,Zn E(V) Cu2++2e=Cu (s) +0.337 Pb2++2e Pb (s) 0.126 Zn2++2e=Zn (s) 0.763 Cd2++2e=Cd (s) -0.403 02,C2 2H20=02+4Ht+4e +1.229 2CI Cl,2 e +1.359 故:分解电压=电解池的反电动势=阳极平衡电 位一阴极平衡电位→(可逆) E分=9析(阳)一9析(阴)
如:Cu, Pb, Cd, Zn Eº(V) Cu2+ + 2e = Cu(s) +0.337 Pb2+ + 2e = Pb (s) 0.126 Zn2++2e=Zn(s) 0.763 Cd2++2e=Cd(s) -0.403 O2,Cl2 2H2O = O2+ 4H++ 4e - +1.229 2Cl- = Cl2 + 2 e +1.359 故:分解电压=电解池的反电动势=阳极平衡电 位—阴极平衡电位→(可逆) E分 =φ析(阳)—φ析(阴)

二、极化现象及过电位 ■ 极化:电极电位偏离其平衡值。 过电位:外加电压超过可逆电池电动势的值 口 F+|1ena9a9平)>0 mb=pe9平)<0 V分=9ap=l9平y9c平+(4ale) =V分理十门 所以V外=V分+R=V分理)+十R
二、极化现象及过电位 ◼ 极化:电极电位偏离其平衡值。 ◼ 过电位:外加电压超过可逆电池电动势的值η η=ηa +∣ηc∣ ηa=φa - φa(平)﹥0 ηb = φc - φc(平)﹤0 V分= φa - φc=[ φa(平) - φc(平) ]+(ηa -ηc ) = V分(理)+ η 所以V外=V分+ iR = V分(理)+ η+ iR